
【题目】把含(NH4)2SO4和NH4NO3的混合液aL分成两等份。一份加入bmolNaOH并加热,恰好把NH3全部赶出;另一份需消耗cmolBaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为()
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。
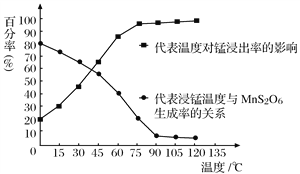
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是
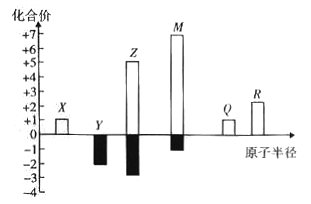
A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从牛至精油中提取的三种活性成分的结构简式如下图所示,下列说法正确的是

A. a中含有2个手性碳原子(手性碳原子指连有四个不同基团的碳原子)
B. b分子存在属于芳香族化合物的同分异构体
C. c分子中所有碳原子可能处于同一平面
D. a、b、c均能发生加成反应、取代反应、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____mol。
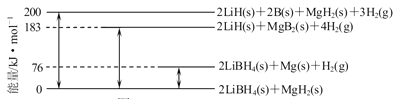
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H=________。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是____(填字母)。
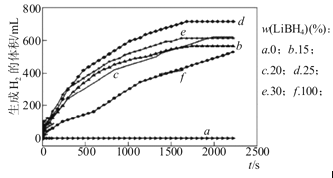
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
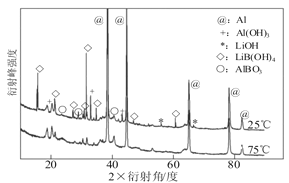
从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是___________(填化学式),产生Al(OH)3的化学方程式为_________________。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”),负极的电极反应式为________________________。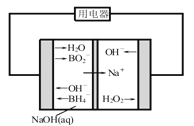
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1024个OH的物质的量为________mol,含有电子的数目为________,这些OH和________gNa+含有的电子数相同。
(2)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为______;
(3)实验室为确定一瓶稀盐酸的浓度,用0.1000mol/LNaOH溶液中和25.00mL该盐酸,当酸与碱恰好完全反应时,消耗NaOH溶液24.50mL。该盐酸的物质的量浓度为______;
(4)实验室可以用高锰酸钾和浓盐酸反应制备氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,用双线桥标出电子转移的方向和数目___________,该反应中被氧化的元素是________,参加反应的氧化剂与还原剂的物质的量之比为________,如果该反应过程中转移了5mol电子,生成的氯气在标准状况下体积为__________L(假设气体全部逸出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,T单质但难溶于水微溶于酒精。下列说法正确的是
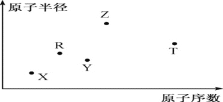
A. 最高价氧化物对应水化物的酸性:R>T
B. 氢化物的沸点一定是Y>R
C. 原子半径和离子半径均满足Y<Z
D. 由X、Y、Z、T四种元素组成的化合物中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )
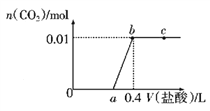
A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、SO32-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )

A.该溶液X中可能有Fe3+、Na+
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有NH4+
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在SO42-、SO32-中的某一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com