
科学家一直致力于“人工固氮”的新方法研究.
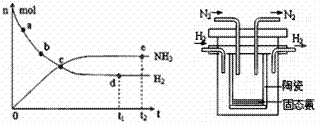
(1)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ•mol﹣1.
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示.下列叙述正确的是 .
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图,阴极的电极反应式 .
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)⇌2NH3(g)+ O2(g)△H=a kJ•mol﹣1
O2(g)△H=a kJ•mol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323:] |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;△S 0(填“>”、“<”或“=”);该反应属于
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJ•mol﹣1则N2(g)+3H2O(1)=2NH3(g)+ O2(g)△H= kJ•mol﹣1.
O2(g)△H= kJ•mol﹣1.
| 物质的量或浓度随时间的变化曲线;热化学方程式;焓变和熵变;化学平衡的影响因素. | |
| 专题: | 基本概念与基本理论. |
| 分析: | (1)A.浓度越大反应速率越快; B.a、b、c之后氢气的物质的量继续变化,未达到平衡,反应向正反进行; C.d、e对应氢气、氨气的物质的量不变,处于平衡状态; D.该反应正反应是放热反应,温度升高平衡向逆反应移动; (2)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气; (3)①由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,结合反应方程式中各物质的聚集状态解答; ②利用盖斯定律计算. |
| 解答: | 解:(1)A.a点反应物的浓度大于b点,浓度越大反应速率越快,故a点反应速率更大,故A正确; B.点c之后氢气的物质的量继续减小,未达到平衡,反应向正反进行,故B错误; C.d、e对应氢气、氨气的物质的量不变,处于平衡状态,点d和点e处的n (N2)相同,故C正确; D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氨气的物质的量减小,故D错误; 故选AC; (2)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e﹣=2NH3, 故答案为:N2+6H++6e﹣=2NH3; (3)①由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,则正反应应为吸热反应,a>0,由方程式可知反应生成气体的物质的量增多,则△S>0,所以该反应在高温下才能自发进行,选C,故答案为:>;>;C; ②已知:①N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1 则利用盖斯定律,将①×2﹣②×3可得,常温下氮气与水反应生成氨气与氧气的热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g),△H=2×(﹣92.4kJ•mol﹣1)﹣3×(﹣571.6kJ•mol﹣1)=+1536kJ•mol﹣1,所以反应N2(g)+3H2O(1)=2NH3(g)+ 故答案为:+768. |
| 点评: | 本题主要考查了平衡的判断、电极反应、反应进行的方向、热化学方程式的书写等知识点,中等难度. |


科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3﹢+3H2↑ |
|
| B. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+H﹢=Al3﹢+H2O |
|
| C. | 碳酸氢钠溶液中加入氢氧化钠:HCO3﹣+OH﹣=CO32﹣+H2O |
|
| D. | 碳酸钙与稀硝酸反应:CO32﹣+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g•cm﹣3.RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀.
④将沉淀过滤、洗涤、干燥后称重,得到固体c g.
回答下列问题:
(1)装置中长玻璃管的作用是 .
(2)该卤代烷中所含卤素的名称是 ,判断依据是 .
(3)如R为乙基,则RX与KOH醇溶液反应的方程式为:
(4)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值
A.偏大 B.偏小 C.不变 D.大小不定.
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
|
| B. | 电池负极的电极反应式为Zn﹣2e﹣+2 OH﹣=Zn(OH)2 |
|
| C. | 电池工作时,电流由正极通过外电路流向负极 |
|
| D. | 碱性锌锰电池是二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)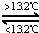 Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是( )
|
| A. | △H1>△H2 |
|
| B. | 锡在常温下以灰锡状态存在 |
|
| C. | 灰锡转为白锡的反应是放热反应 |
|
| D. | 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是 ( )
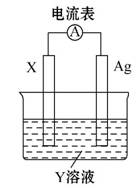
A.电解质溶液Y是CuSO4溶液
B.电极X的材料是Cu
C.银电极为电池的正极,其电极反应为Ag++e-====Ag
D.外电路中的电子是从X电极流向Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是 。
甲同学的设计思路是 。
(2)乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象
是 。
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是 。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂 溶液(作为电解液)。反应在调控下随即开始,实验中有关反应的化学方程式为 。实验中的明显现象是 。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报.
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母).
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒.感冒发烧病人可服用 药品进行治疗(填字母).
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力.维生素C的结构简式是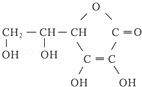 ,它的分子式是 .在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性.
,它的分子式是 .在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性.
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂: 1.00 mol·L-1 HNO3、2.00 mol·L-1
HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
__________________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(3)整个实验中应控制的不变量是硝酸溶液体积和________。
(4)该实验小组用如图实验装置进行实验。

①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有__________。
②干燥管中应放置的试剂是______。
A.碱石灰 B.无水CaCl2
C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com