
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA |
分析 A、求出超重水的物质的量,然后根据1mol超重水中含12mol中子;
B、标况下四氯化碳为液态;
C、NO2和N2O4的最简式均为NO2;
D、合成氨的反应为可逆反应.
解答 解:A、9g超重水的物质的量为n=$\frac{9g}{22g/mol}$=$\frac{9}{22}$mol,而1mol超重水中含12mol中子,故$\frac{9}{22}$mol超重水中含4.9mol中子即4.9NA个,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量为2mol,则含有6NA个原子,故C正确;
D、合成氨的反应为可逆反应,故不能进行彻底,故转移的电子数小于6NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 锂、钠、钾、铷、铯都具有碱性,故称为碱金属 | |
| B. | 石灰石、纯碱、小苏打、碳酸铵热稳定性最强的是纯碱 | |
| C. | 过氧化钠投入到饱和碳酸钠溶液既能产生白色沉淀,又能产生气体 | |
| D. | 金属Li是密度最小的碱金属,熔点大于Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,若阳极有64g铜放电溶解,则理论上电路中转移的电子数为2NA | |
| B. | 7.8g Na2O2与Na2S的混合物中含有的阴、阳离子的总数为0.3NA | |
| C. | 0.1 mol/LNa2CO3溶液中所含阴离子的总数大于0.1NA | |
| D. | 标准状况下22.4L三氯甲烷含有氯原子的数目是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X溶液 | 现象 |  | |
| A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
| B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
| C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| D | 紫色石蕊溶液 | 溶液先变红后褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KMnO_{4}aq}{→}$
$\stackrel{KMnO_{4}aq}{→}$
 $→_{△}^{HBr}$
$→_{△}^{HBr}$ 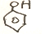
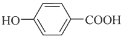 +CH3CH2CH2OH$→_{△}^{浓硫酸}$
+CH3CH2CH2OH$→_{△}^{浓硫酸}$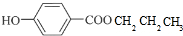 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
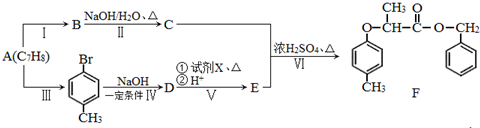

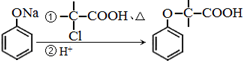
 +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$  +NaCl.
+NaCl. .
. 为原料制取
为原料制取 的合成路线图.
的合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁在空气中被氧化:4Fe2++3O2+6H2O═4Fe(OH)3 | |
| B. | 向CH2Br-COOH中加入足量的NaOH溶液并加热:CH2Br-COOH+OH-$\stackrel{△}{→}$CH2Br-COO-+H2O | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B元素在周期表中的位置为第二周期ⅣA族 | |
| B. | D的氧化物和E的单质的水溶液均有漂白性,且漂白的原理相同 | |
| C. | 由A、B、C、D组成的两种盐的溶液反应可产生DB2气体 | |
| D. | 上述元素的非金属气态氢化物还原性最强的是E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com