
分析 (1)二者反应实质是氯离子与银离子生成氯化银;
(2)二者反应生成氯化钙和水、二氧化碳;
(3)二氧化碳少量反应生成碳酸钾和水;
(4)NaHSO4溶液与Ba(OH)2溶液混合后恰好中和,反应生成硫酸钡、硫酸钠和水.
解答 解:(1)向NaCl溶液中滴加硝酸银溶液,离子方程式:Ag++Cl-=AgCl↓;
故答案为:Ag++Cl-=AgCl↓;
(2)向碳酸钙中加入盐酸,离子方程式;CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)少CO2通入KOH溶液中,离子方程式:CO2+2OH-=CO32-+H2O;
故答案为:CO2+2OH-=CO32-+H2O;
(4)NaHSO4溶液与Ba(OH)2溶液混合后恰好中和,反应生成硫酸钡、硫酸钠和水,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O;
故答案为:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O.
点评 本题考查了离子方程式的书写,明确物质的性质及离子方程式的书写是解题关键,注意化学式的拆分,注意离子反应遵循客观事实,题目难度不大.


科目:高中化学 来源: 题型:解答题
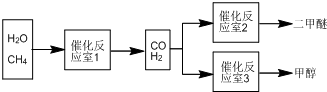
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发废旧电池综合利用技术,防止重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 倡导低碳生活,使用太阳能、风能等代替化石燃料,可减少温室气体的排放 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
| A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
| B | NaCl(NH4Cl) | 加热 | 加热 |
| C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
| D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20gNaOH溶解在500mL水中 | |
| B. | 将22.4L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L的KCl溶液 | B. | 30mL 1mol/L的NaCl溶液 | ||
| C. | 30mL 3mol/L的FeCl3溶液 | D. | 10mL3mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
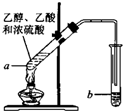 (1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:
(1)在实验室可使用如图装置制取乙酸乙酯,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com