
| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 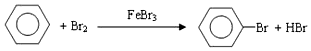 |
分析 “原子经济”就是反应物的原子全部转化为期望的最终产物,对于无机反应来说应该是化合反应,对于有机反应来说应该是加成反应或加聚反应,据此分析解答.
解答 解:“原子经济”就是反应物的原子全部转化为期望的最终产物,对于无机反应来说应该是化合反应,对于有机反应来说应该是加成反应或加聚反应,
A.该反应中除了生成硫酸铜外还生成二氧化硫和水,不符合原子经济,故A错误;
B.该反应中除了生成硝酸铜外还生成二氧化氮和水,不符合原子经济,故B错误;
C.该反应为加成反应,产物只有一种,符合原子经济,故C正确;
D.该反应为取代反应,除了生成溴苯外还生成HBr,不符合原子经济,故D错误;
故选C.
点评 本题考查原子经济,为高频考点,侧重考查学生获取信息解答问题能力,正确理解原子经济概念是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应: ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、SO42-、Cl- | D. | Na+、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处 | |
| D. | 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰水与盐酸的反应 OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ•mol-1 | B. | 649kJ•mol-1 | C. | 896kJ•mol-1 | D. | 946kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com