
【题目】下列分散系中,能产生丁达尔效应的是( )
A.硫酸铜溶液 B.硫酸溶液 C.氯化铁溶液 D.氢氧化铝胶体
科目:高中化学 来源: 题型:
【题目】《神农本草经》说:“水银熔化(加热)还复为丹”;《黄帝九鼎神丹经》中的“柔丹”、“伏丹”,都是在土釜中加热Hg制得的。这里的“丹”是指
A.氯化物 B.合金 C.硫化物 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置能制取并收集到相应气体的是
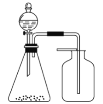
A.浓氨水与固体CaO制氨气
B.盐酸与CaCO3固体制CO2
C.稀硝酸与铜片制NO
D.饱和食盐水与电石制乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)![]() CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为 。
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | a | b |
III | 207 | 0.20 | 0.090 | 0.090 |
(4) 容器I中的反应达到平衡时所需的时间_______(填“大于”“小于”或等于)容器II中的。
(5) a=
(6) 下列说法中能说明该反应达到平衡状态的是 。(填字母)
A.容器中压强不变
B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变
D.单位时间内生成1 mol CH3OCH3 同时消耗2molCH3OH
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是 (填字母)。
A.n﹥2m B.m﹥2 n C.2m﹥n D.m﹥3n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:
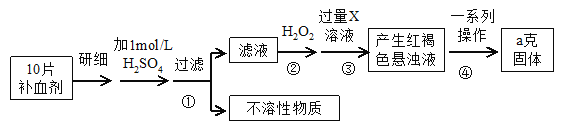
请回答下列问题:
(1) 证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2) 步骤②加入过量H2O2的目的: 。
(3) 步骤③中反应的离子方程式: 。
(4) 步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5) 若实验无损耗,则每片补血剂含铁元素的质量 g。
(6) 该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。若滴定到终点时俯视滴定管刻度线,对测量值有何影响 ( 填 “偏高、偏低或无影响” )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.大量燃烧化石燃料是造成雾霾的一种重要因素
B.食品中的抗氧化剂本身是难于氧化的物质
C.含SO42﹣的澄清溶液中不会含Ba2+
D.凡溶于水能电离出H+离子的化合物均属于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48LHF,则转移0.8mol电子
D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO![]() 、Cl-、NO
、Cl-、NO![]() 、CO
、CO![]() ,阳离子可能是Ag+、NH
,阳离子可能是Ag+、NH![]() 、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是__________________
(2)M溶液显碱性的原因是(用离子方程式表示)______________________
(3)X和Z的溶液反应的离子方程式是_______________________
(4)N和氨水反应的离子方程式是___________________________
(5)若要检验Y中所含的阳离子,正确的实验方法是____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com