
| A. | NH3,H2,CH4 | B. | PCl5,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
分析 化合物由两种或两种以上的元素组成的纯净物.分子间通过分子间作用力(包括范德华力和氢键)构成的晶体.常见的分子晶体有:所有非金属氢化物、部分非金属单质(金刚石、晶体硅等除外)、部分非金属氧化物(二氧化硅等除外)、几乎所有的酸、绝大多数的有机物晶体、所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、易挥发的固态物质等.
解答 解:A、NH3、CH4属于分子晶体的化合物,H2是单质,不是化合物,故A错误;
B、PCl3,CO2,H2SO4属于分子晶体的化合物,故B正确;
C、SO2、P2O5属于分子晶体的化合物,SiO2为原子晶体,不是分子晶体,故C错误;
D、CCl4、H2O2属于分子晶体的化合物,Na2S是离子晶体,不是分子晶体,故D错误.
故选:B.
点评 考查常见物质晶体类型判断等,难度不大,掌握常见物质晶体类型及常见分子晶体.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(YX)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
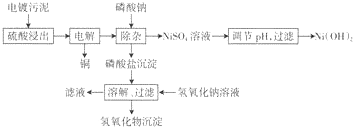
| 金属离子 | Cu3+ | Ni3+ | Fe3+ | Al3+ | Cr3+ |
| 浓度(mg/L) | 7000 | 7000 | 2500 | 4200 | 3500 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3CH2CH2CH2CH3 | C. | 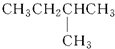 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 70% | C. | 47.6% | D. | 52.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⑤
⑤

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
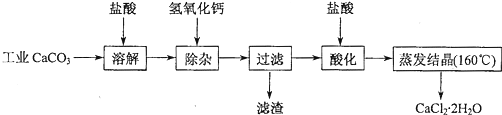
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
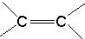 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此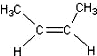 和
和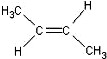 是两种不同的化合物,互为顺反异构体.则分子式为C3H4Cl2的化合物的烯烃异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H4Cl2的化合物的烯烃异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com