
【题目】I已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1
O2(g)═H2O(l);△H=-285.8kJmol-1
②H2(g)+![]() O2(g)═H2O(g);△H=-241.8kJmol-1
O2(g)═H2O(g);△H=-241.8kJmol-1
③CO(g)═C(s)+![]() O2(g);△H=+110.5kJmol-1
O2(g);△H=+110.5kJmol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1
回答下列问题:
(1)上述反应中属于放热反应的是_________________
(2)H2的燃烧热△H=___________________
(3)燃烧10gH2生成液态水,放出的热量为________________
(4)表示CO燃烧热的热化学方程式为.________________
II已知:(1)P4(s,白磷)+5O2(g)==P4O10(s)△H1=-2983.2kJ/mol
(2)P(s,红磷)+ ![]() O2(g)=
O2(g)= ![]() P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
P4O10(s) △H1=-738.5kJ/mol,则白磷转化为红磷的热化学方程式_________________。相同的状况下,能量较低的是_________________;白磷的稳定性比红磷_________________(填“高”或“低”)
【答案】①②④ -285.8kJmol-1 1429KJ C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1 P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol 红磷 低
【解析】
I (1)根据热化学方程式中△H的符号判断;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(3)根据物质的量之比等于热量比求算;
(4)结合盖斯定律计算得到,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
II根据盖斯定律进行求算;物质的能量越低越稳定。
I (1)由已知热化学方程式中△H的符号可知,四个反应的△H①②④均为负值,即都是放热反应;③的为正值,即为吸热反应;
故答案为:①②④;
(2) H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1,依据燃烧热概念可知H2的燃烧热△H= -285.8kJmol-1;
O2(g)═H2O(l);△H=-285.8kJmol-1,依据燃烧热概念可知H2的燃烧热△H= -285.8kJmol-1;
(3) H2(g)+![]() O2(g)═H2O(l);△H=-285.8kJmol-1,燃烧10g H2的物质的量为5mol ,则燃烧10g H2生成液态水,放出的热量为285.8
O2(g)═H2O(l);△H=-285.8kJmol-1,燃烧10g H2的物质的量为5mol ,则燃烧10g H2生成液态水,放出的热量为285.8![]() 5= 1429.0kJ ;
5= 1429.0kJ ;
(4) ③CO(g)═C(s)+![]() O2(g);△H=+110.5kJmol-1
O2(g);△H=+110.5kJmol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJmol-1
依据盖斯定律④+③得到CO(g)+ ![]() O2(g)=CO2(g) △H = - 283.0kJ/mol;CO燃烧热的热化学方程式为CO(g)+
O2(g)=CO2(g) △H = - 283.0kJ/mol;CO燃烧热的热化学方程式为CO(g)+ ![]() O2(g)=CO2(g) △H = - 283.0kJ/mol;
O2(g)=CO2(g) △H = - 283.0kJ/mol;
II红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:(1)P4O10(s)=P4(s、白磷)+5O2(g);△H=2983.2kJ/mol;
(2)4P(s、红磷)+5O2(g)=P4O10(s);△H=-738.5×4kJ/mol=-2954kJ/mol;
根据盖斯定律,红磷转化为白磷4P(s、红磷)=P4(s、白磷)的△H=2983.2kJ/mol-2954kJ/mol=+29.2kJ/mol;
故答案为:4P(s、红磷)=P4(s、白磷)△H=+29.2kJ/mol;
相同的状况下,能量较低的是红磷;能量越低越稳定,则白磷的稳定性比红磷低。


科目:高中化学 来源: 题型:
【题目】研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是
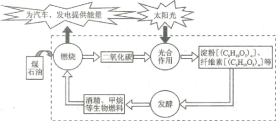
A. 石油与煤是可再生能源
B. CO2是煤、石油形成淀粉、纤维素等的催化剂
C. 光合作用将太阳能转化为化学能
D. 图中所出现的物质中淀粉与纤维素为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验操作及结论的描述不正确的是( )
A.![]() 如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好
如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好
B.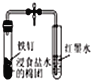 如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
C.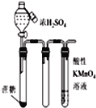 如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳
如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳
D.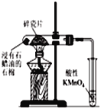 如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了不饱和烃
如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某课外小组从初选后的方铅矿(主要成分PbS,含少量黄铜矿(CuFeS2))中提取硫磺、铜、铅的工艺流程:
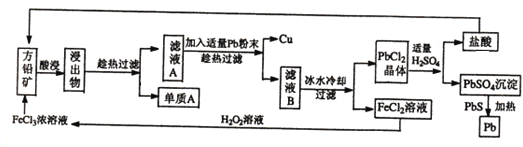
已知:CuFeS2+4FeCl3=2S+5FeCl2+CuCl2 、PbS+2FeCl3=S+PbCl2+2FeCl2
(1)黄铜矿( CuFeS2 )中Fe元素的化合价为 ______ ,提高方铅矿酸浸效率的措施有 ______ (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ______ ;单质A是 ______ ,在此工艺操作中可循环利用的物质有铅和 ______ 。
(3)在酸性的FeCl2溶液中加入H2O2溶液,其反应的离子方程式为 ______ 。
(4)PbSO4与PbS加热条件下反应的化学方程式为 ______ 。
将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化可转化为PbCO3,写出该反应的平衡常数表达式:K= ______ 。(已知Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸;铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g)+B(g)C(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )
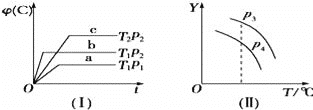
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:

已知:①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3kJmol-1
SO2Cl2(l) △H=-97.3kJmol-1
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_________。
(2)仪器b的名称为_________。
(3)装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为___。当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率 _________。为提高硫酰氯的产率,本实验操作中还需要注意的事项有___(只答一条即可)。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________,分离两种产物的方法是_________。
(5)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应。_________(简要描述实验步骤、现象和结论)。仪器自选;供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
(6)长期存放的硫酰氰会发黄,其原因可能为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中高压放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是

A.两种方法都是将电能转化为化学能
B.高压放电法和电解纯水法相比,会产生污染性的NOx气体
C.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
D.电解纯水时,H+由电极b流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,食盐晶体由钠离子和氯离子构成。已知食盐的M=58.5g·mol-1,食盐的密度是2.2g·cm-3,阿伏加德罗常数为6.0×1023mol-1,在食盐晶体中两个距离最近的钠离子中心间的距离最接近下列哪个数据( )
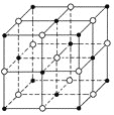
A.3.0×10-8cmB.3.5×10-8cmC.4.0×10-8cmD.5.0×10-8cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 溶液橙色变深 | 增大生成物浓度,平衡 |
B | 向较浓的 |
|
|
C | 取 | 溶液中出现砖红色 | 淀粉完全水解 |
D | 分别向 | 加入 | 反应物的浓度越大,反应速率越快 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com