
| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 新制的0.1mol/L氯水中加入少量的CaCO3固体,HClO的物质的量浓度减小 | |
| C. | Na2O和Na2O2都能与H2O反应,其反应原理不相同 | |
| D. | O3、H2O2、SO2、Na2O2均有漂白性,其原理不尽相同 |
分析 A、明矾水溶液中铝离子水解生成氢氧化铝胶体,吸附悬浮杂质,净水作用,次氯酸钙有强氧化性的物质具有杀菌消毒的作用;
B、加入碳酸钙和氯水中盐酸反应促进化学平衡正向进行,次氯酸浓度增大;
C、氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气;
D、O3、H2O2、Na2O2均有漂白性是氧化性的体现,SO2的漂白性不是氧化性.
解答 解:A、明矾溶液水电离产生的铝离子水解生成的氢氧化铝具有吸附性,能净水,但是明矾不具有强的氧化性所以不能杀菌消毒,漂白粉有效成分为次氯酸钙,次氯酸钙有强氧化性,可以杀菌消毒,故A错误;
B、氯水中存在化学平衡Cl2+H2O?HCl+HClO,加入少量的CaCO3固体,和盐酸反应促进平衡正向进行,次氯酸酸性小于碳酸,不与碳酸钙发生反应,HClO的物质的量浓度增大,故B错误;
C、氧化钠和水反应生成氢氧化钠,属于非氧化还原反应,过氧化钠和水反应生成氢氧化钠和氧气是氧化还原反应,二者反应原理不同,故C正确;
D、O3、H2O2、Na2O2均有漂白性是氧化性的体现,能氧化有机色素为无色,SO2的漂白性不是氧化性,是二氧化硫和有色物质结合生成不稳定的无色物质,加热恢复颜色,原理不同,故D正确;
故选AB.
点评 本题考查了物质性质的理解应用,主要是盐类水解,化学平衡影响因素分析,物质漂白性的原理分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:
醇的化学性质主要由羧基官能团所决定,如1-丁醇在银催化的条件下能与氧气反应生成正丁醛.相应醇和醛的有关物理性质如表:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1-丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
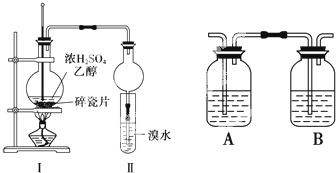 某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于如图所示装置的叙述:①Zn为正极,Cu为负极;②溶液中氢离子向负极移动;③电子从锌片经导线流向铜片;④铜极上有氢气产生;⑤若有0.1mol电子流过导线时,锌片质量减轻6.5g;⑥若有1mol电子流过导线,则产生的氢气为0.5mol.正确的是( )
关于如图所示装置的叙述:①Zn为正极,Cu为负极;②溶液中氢离子向负极移动;③电子从锌片经导线流向铜片;④铜极上有氢气产生;⑤若有0.1mol电子流过导线时,锌片质量减轻6.5g;⑥若有1mol电子流过导线,则产生的氢气为0.5mol.正确的是( )| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com