
 反应时断裂的化学键是( )
反应时断裂的化学键是( )| A. | ①③ | B. | ①④ | C. | ② | D. | ②③ |
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
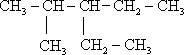 ;
;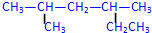 2,4-二甲基己烷
2,4-二甲基己烷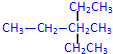 3-甲基-3-乙基戊烷
3-甲基-3-乙基戊烷 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$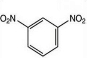 +2H2O.
+2H2O.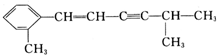 该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应I | 反应II |
| A | 在光照条件下,异丁烷与溴蒸气反应制取(CH3)3CBr | 将乙烯通入溴的四氯化碳溶液中制取1,2一二溴乙烷 |
| B | 在镍作催化剂的条件下,苯与氢气反应生成环乙烷 | 在催化剂作用下,乙烯与水反应生成乙醇 |
| C | 在银作催化剂的条件下,乙醇与空气中的氧气反应生成乙醛 | 在一定条件下,由氯乙烯(CH2=CHCl)合成聚氯乙烯 |
| D | 乙酸乙酯在酸的催化作用下与水反应生成乙酸和乙醇 | 在一定条件下,液态油脂与氢气反应制造人造脂肪 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
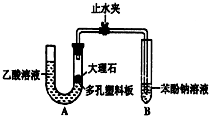 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题:
H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流出的一极是正极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,电子有负极向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com