
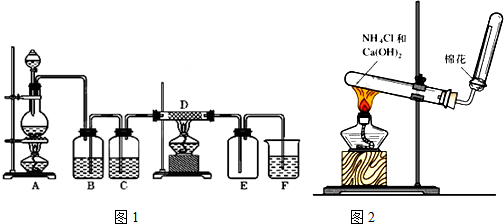
分析 (1)①根据气体流向可知,B装置中导管应是长进短出;
②二氧化锰和浓盐酸加热生成氯气、氯化锰与水;
③制备的氯气中含有HCl,需要吸收除去;
④D中是氯气氯气与Fe反应生成氯化铁;
(2)①实验室用氢氧化钙与氯化铵在加热条件下制备氨气,反应生成氯化钙、氨气与水;
②干燥氨气的干燥剂通常用碱石灰;
③氨气能使湿润的红色石蕊试纸变蓝.
解答 解:(1)①根据气体流向可知,装置图中B错误,B装置中导管应是长进短出,
故答案为:B;
②二氧化锰和浓盐酸加热生成氯气、氯化锰与水,反应方程式为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O,
故答案为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
③盐酸易挥发,制备的氯气中含有HCl,用饱和食盐水除去Cl2中的HCl,
故答案为:除去Cl2中的HCl;
④D中是氯气氯气与Fe反应生成氯化铁,反应方程式为:3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:3Cl2+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(2)①实验室用氢氧化钙与氯化铵在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②干燥氨气的干燥剂通常用碱石灰,故答案为:碱石灰;
③检验氨气是否收集满的方法:用湿润的红色石蕊试纸置于收集气体的试管口,试纸变蓝,则收满,
故答案为:用湿润的红色石蕊试纸置于收集气体的试管口,试纸变蓝,则收满.
氨气能使湿润的红色石蕊试纸变蓝.
点评 本题考查物质制备实验,涉及氯气与氨气的制备、气体检验、对装置的分析评价等,掌握常见气体制备,一般有发生装置、净化装置、收集装置、尾气处理装置等.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液 | |
| B. | 相同温度下,pH相等的NaHCO3溶液、NaClO溶液、NaOH溶液:c(NaClO)>c(NaHCO3)>c(NaOH) | |
| C. | 常温下,CH3COONa与HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验组 | 温度℃ | 起始量mol | 平衡量mol | 达平衡所需时间min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: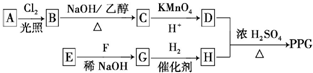
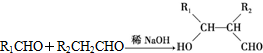

 .
. .
. .
.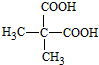
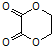 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
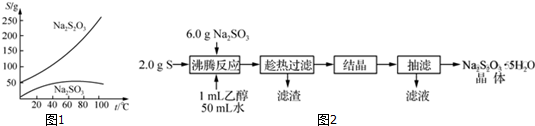
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com