
【题目】用惰性电极实现下列电解实验,其说法正确的是
A. 电解稀硫酸溶液,实质上是电解水,故溶液的c(H+)不变
B. 电解稀氢氧化钠溶液,阳极消耗OH-,故溶液的碱性减弱
C. 电解硫酸钠溶液,阴极和阳极析出产物的物质的量之比为2:1
D. 电解氯化铜溶液一段时间后,向溶液中加入适量的CuO可使电解液恢复到起始状态
科目:高中化学 来源: 题型:
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br﹣、2Fe3++2I﹣═2Fe2++I2 , 则下列有关说法中不正确的是( ) 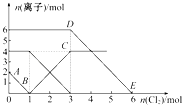
A.还原性:I﹣>Fe2+>Br﹣
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n(Br﹣)=6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的氧化剂是 ,
(2)该反应中,发生还原反应的过程是→ ,
(3)写出该反应的化学方程式,并用双线桥标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产工艺流程如下:

(1)操作1的操作是_________;
(2)升高pH至4.0~4.5的目的是_______________ ;
(3)生产过程中可回收使用的物质是__________(写物质名称);
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用______(填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)通过该法得到一种化学式为[Al2(OH)2Cl45H2O]10的(M=320 g/mol)聚合氯化铝晶体,为测定产品纯度,进行如下操作:
①称取1.600g样品,用适量盐酸溶解后配成100.00 mL溶液;
②取25.00 mL溶液,控制pH=3.5,加入过量0.1 mol/L 40 mL EDTA(Na2H2Y2H2O)标准液滴定(Al3+ + H2Y2 = AlY + 2H+),加热煮沸5~10分钟,使Al3+与EDTA结合稳定(EDTA与Al3+结合无色);
③待上一步结束后,调节溶液pH至5~6,加入二甲酚橙作指示剂,用0.1 mol/L标准Zn2+溶液滴定多余的EDTA(Zn2+ + H2Y2 = ZnY2 + 2H+),消耗标准液20.00 mL(已知:二甲酚橙与Zn2+形成的配合物是红紫色的溶液)滴定终点的现象是_________________;产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解AgNO3溶液,下列说法不正确的是
A. 电解过程中阴极质量不断增加
B. 电解过程中溶液的pH不断降低
C. 此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D. 电解时阴极产生的气体为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的气体x(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
A. 0.3mol NO2和0.3mol NO
B. 0.2mol NO2和0.1mol N2O4
C. 0.6mol NO
D. 0.1mol NO、0.2mol NO2和0.05mol N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由相关实验现象所推出的结论正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42—
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把表面有氧化物的铜片和铁片一起放入盐酸中充分反应后铁片未完全溶解,在该溶液中的金属离子应是( )
A. 只有Fe2+ B. Fe3+和Cu2+
C. Fe2+和Cu2+ D. Fe3+和Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由KClO3变成KCl必须加入还原剂
B.向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低
C.已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10%
D.一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com