
| 容器编号 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
分析 (1)平衡常数为生成物、反应物浓度幂之积的比值,结合方程式列式;
(2)提高CO产率,应使平衡正向移动;
(3)由反应Ⅰ达到平衡状态,可求出反应的平衡常数,根据平衡常数计算并判断反应的进行方向;
(4)根据反应方程式利用三段式法计算,转化的水蒸汽为x,根据体积之比等于物质的量之比计算;
(5)根据2.4gC与水反应生成的CO和H2的物质的量,利用热化学方程式计算.
解答 解:(1)反应C(s)+H2O(g)?CO(g)+H2(g)中,C为固体,则K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$,故答案为:$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;
(2)A.正反应为吸热反应,则升高温度,平衡正向移动,CO的产率增大,故A正确;
B.降低压强,平衡正向移动,CO的产率增大,故B正确;
C.增加固体的用量平衡不移动,故C错误;
D.通入H2平衡逆向移动,故D错误.
故答案为:AB;
(3)由反应Ⅰ达到平衡状态可知,反应的平衡常数K=$\frac{0.1×0.60}{0.06}$=1,
反应Ⅱ中Qc=$\frac{0.4×0.5}{0.06}$=3.33>1,则反应向逆反应方向移动,即V正<V逆,
反应Ⅳ中V正=V逆,说明反应达平衡状态,则有$\frac{0.3×c({H}_{2})}{0.12}=1$,c(H2)=0.4mol/L,
故答案为:①V正<V逆;②0.40;
(4)根据反应方程式利用三段式法计算,转化的水蒸汽为x,根据体积之比等于物质的量之比计算,
C (s)+H216O(g)  C16O (g)+H2 (g)
C16O (g)+H2 (g)
起始:1mol 0 0
转化:x x x
平衡:1-x x x
则有:$\frac{(1-x)+x+x}{1}=1.25$,x=0.25mol,所以转化率为$\frac{0.25}{1}×\;100%$=25%,
增加固体的对反应速率和化学平衡都没有影响,水蒸气的转化率不变,
恒温恒压下,再补充 a mol 水蒸气 (H218O),平衡状态不变,为等效平衡,水的转化率相等,则有生成的C18O 的物质的量为a×25%=0.25a,
所以达平衡时C16O和C18O 的物质的量之比为0.25:0.25a=1:a,
故答案为:25%;不变;1:a;
(5)n(C)=$\frac{2.4g}{12g/mol}$=0.2mol,与水反应生成0.2molCO和0.2molH2,反应吸收的热量为0.2mol×131.3KJ/mol=26.26KJ,
0.2molCO完全燃烧放出的热量为0.2mol×283KJ/mol=56.6KJ,
0.2molH2完全燃烧放出的热量为0.2mol×241.8KJ/mol=48.36KJ,
所以将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程放出的热量为56.6KJ+48.36KJ-26.26KJ=78.7KJ,
整个过程△H=-78.7kJ•mol-1,
故答案为:-78.7.
点评 本题考查化学平衡的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,本题难度不大,做题时注意平衡常数的计算和应用.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O中所含的粒子数目一定是NA | |
| B. | 1 molNH4+所含的质子数是10NA | |
| C. | 51 g NH3所含原子数为3NA | |
| D. | 氧气的相对分子质量与2NA个氧原子质量(以g为单位)在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH | |
| B. | 除去金属离子Cu2+、Hg2+,可向溶液中加入H2S、Na2S等沉淀剂 | |
| C. | 除去某溶液中的SO42-可向溶液中加入镁盐 | |
| D. | 除去ZnCl2溶液中的Fe3+可向溶液中加入ZnO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA | |
| B. | 1 mol-OH中电子数为10 NA | |
| C. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| D. | 常温常压下,28 g丙烯和丁烯的混合气体中含有的碳原子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
? +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
查看答案和解析>>
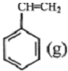
科目:高中化学 来源: 题型:推断题

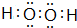 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com