
【题目】下列六种短周期元素(用字母x等表示)。最高正价或最低负价与原子序数关系如图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是______。已知x为非金属元素,由x、e、g三种元素组成的离子化合物的电子式:______。
(2)上述元素简单离子半径最大的是(用化学式表示,下同):___;比较g、h的最高价氧化物对应水化物的酸性强弱:_____。
(3)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:__________。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是____(填化学式),此化合物可将碱性工业废水中的CN-氧化,生成碳酸盐和氨气,相应的离子方程式为__________。
【答案】第三周期IIIA族 Na+![]() S2- HClO4 >H2SO4 2Na(s)+O2(g)=Na2O2(s) ΔH=-511kJ·mol-1 H2O2 H2O2+CN-+OH-=CO32-+NH3↑
S2- HClO4 >H2SO4 2Na(s)+O2(g)=Na2O2(s) ΔH=-511kJ·mol-1 H2O2 H2O2+CN-+OH-=CO32-+NH3↑
【解析】
根据图像可知,x、d、e、f、g、h原子序数依次增大,已知x为非金属元素,根据化合价可判断x、d、e、f、g、h六种元素分别为:H、O、Na、Al、S、Cl;
(1)f为Al,位于第三周期IIIA族;由H、Na、S三种元素组成的离子化合物为NaHS,其电子式为:Na+![]() ;
;
(2)根据“层多径大,序大径小”,则上述元素简单离子半径最大的是S2-;S、Cl的最高价氧化物对应水化物分别为硫酸、高氯酸,非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性Cl强于S,则酸性高氯酸强于硫酸;答案为:S2-;HClO4 >H2SO4 ;
(3)e为Na,d为O,已知1molNa的单质在足量O2中燃烧,产物为过氧化钠,恢复至室温,放出255.5 kJ热量,热化学方程式为:2Na(s)+O2(g)=Na2O2(s) ΔH=-511kJ/mol;
(4)x和d分别为H、O,组成的化合物中,既含有极性共价键又含有非极性共价键的为过氧化氢,过氧化氢与CN-在碱性条件下发生氧化还原反应,生成碳酸根离子和氨气,反应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3↑;


科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。

下列分析不正确的是
A. 乙烯气相直接水合反应的H<0
B. 图中压强的大小关系为:p1>p2>p3
C. 图中a点对应的平衡常数K =![]()
D. 达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。

① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合下图回答问题。

①此反应的热化学方程式是______
②反应活化能:过程I___过程II(填“>”“=”或“<”)
③过程II温度—转化率图如下,下列说法合理的是_____

a.甲醇脱氢法制备甲醛过程无副反应发生
b.温度高于 650℃催化剂烧结,活性减弱
c.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为____,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为_____mg。

②氧化剂可处理甲醛污染,结合以下图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为______
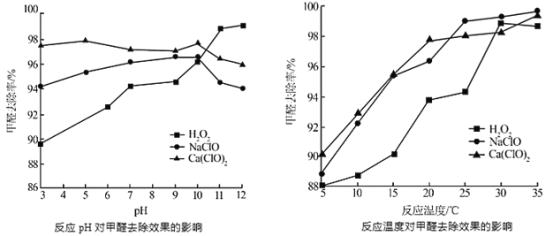
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________,往Na2A溶液中加入___________可抑制其水解
A .NaOH固体 B.氯化铁固体 C.水 D.碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为______ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与4mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH>7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________________________________________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为:_____________________(填“V1>V2”“ V1<V2”“ V1=V2”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温2L密闭容器中通入气体X并发生反应:2X(g) ![]() Y(g) ΔH<0,X的
Y(g) ΔH<0,X的
物质的量n(x)随时间t变化的曲线如下图所示(图中两曲线分别代表有无催化剂的情形)

(1)下列措施不能提高反应速率的是____。
A 升高温度 B 加入适量X C 增大压强 D 及时分离出Y
(2)反应从开始到a点的平均反应速率可表示为v(Y)=_____,X的转化率为____;
(3)____线表示使用催化剂的情形(填“实”或“虚”);
(4)图中c点对应的速率关系是![]() (正)____
(正)____![]() (逆) (填“大于”“小于”或“等于”);
(逆) (填“大于”“小于”或“等于”);
(5)反应进行到a点时放出的热量 _______反应进行到b点时放出的热量(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是

A. 该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 该过程中BMO表现较强氧化性
C. 降解产物的分子中只含有极性共价键
D. ①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铜和浓硫酸的反应,下列装置或操作错误的是
甲 乙
乙  丙
丙
A.上下移动装置甲中的铜丝可控制SO2的生成
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,向甲中反应后的试管中直接加水稀释,观察溶液颜色
D.利用装置丙将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol A气体和1mol B气体通入体积为2 L的密闭容器中发生反应:2A(g)+B(g)=xC(g)+2D(s),2 min达平衡,测得平衡时A的物质的量为1.2mol ,C的浓度为0.6mol·L-1。
(1)从开始反应至达到平衡状态,生成B的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.D的质量不再变化
B.压强不再变化
C.气体密度不再变化
D.气体的平均相对分子质量不再变化
E.A的消耗速率与B的消耗速率之比为2∶1
(5)请结合(4)总结化学平衡状态的判断依据有哪些:_____________(至少写出2条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com