
已知X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.

请根据信息回答有关问题:
(1)元素Y的原子核外共有________种不同运动状态的电子,有________种不同能级的电子.
(2)X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号)________.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)________.
(4)R
的核外电子排布式为________.R的一种配合物的化学式为RCl3·6H2O.已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀.此配合物最可能是________.A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O
D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心原子为(写化学式)________,配位体为(写化学式)________,x的值为________.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为________.
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
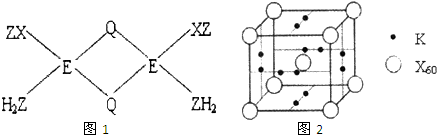 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:填空题
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为???????? ,X、Y、Z中第一电离能最大的是???????? 。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
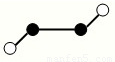
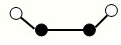
该分子中Y原子的杂化方式是???????? 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是???? (填正确答案编号)。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为????????????? 。
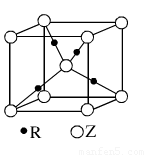
(5)R的基态原子的电子排布式为????????? ,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为????????? ,该晶体的密度为a g·cm-3,则晶胞的体积是????????? cm3。
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期期中考试化学试卷 题型:填空题
(16分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
|
元素 |
结构或性质信息 |
|
X |
原子的L层上s电子数等于p电子数。 |
|
Y |
原子核外的L层有3个未成对电子。 |
|
Z |
在元素周期表的各元素中电负性仅小于氟。 |
|
Q |
单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
|
R |
核电荷数是Y与Q的核电荷数之和 |
|
E |
原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2) X、Y、Z三种元素的第一电离能由高到低的排列次序依次为(写元素符号) 。
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式) 。
(4)R的核外电子排布式为 。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心原子为(写化学式) ,配位体为(写化学式) ,x 的值为 。
(6) Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省聊城市高考化学一模试卷(解析版) 题型:填空题
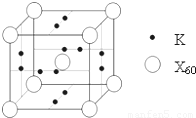
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com