
| A. | 该有机物仅含碳、氧两种元素 | |
| B. | 该有机物中碳、氧、氧原子个数比为1:4:2 | |
| C. | 无法确定是否含有氧元素 | |
| D. | 该有机物中一定含有氧元素 |
分析 化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,根据n=$\frac{m}{M}$计算二氧化碳、水的物质的量,进而计算有机物中C、H原子数目之比,根据m=nM计算C、H元素质量,根据质量守恒定律计算判断化合物中是否含有O元素.
解答 解:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,
8.8g二氧化碳的物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
7.2g水的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,
氧原子物质的量为$\frac{3.2g}{16g/mol}$=0.2mol,故化合物中N(C):N(H):N(O)=0.2mol:0.8mol:0.2mol=1:4:1,该化合物中的最简式为:CH4O,由于H原子已经达到饱和,则其最简式即为其分子式,
综上分析可知,ABC错误,D正确,
故选D.
点评 本题考查有机物组成的确定,侧重考查质量守恒定律,题目难度不大,注意根据质量守恒判断是否含有氧元素.


科目:高中化学 来源: 题型:多选题
| A. | 燃烧是发光、发热的化学反应 | B. | 燃烧必须有02参加 | ||
| C. | 燃烧必须有H20参加 | D. | 燃烧一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
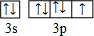 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.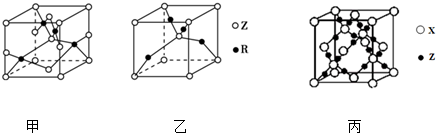
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 molA+2 molB | |
| B. | 4 mol C+1 molD+2mol A+1 mol B | |
| C. | 1.6mol C+0.3 molD+1.2mol A+0.6 mol B | |
| D. | 4 mol C+0.8molD |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,E:HCHO,H:
,E:HCHO,H: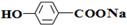 G:HCOOCH3,.
G:HCOOCH3,. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
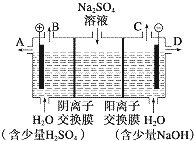 某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用如图实验装置(两电极均为石墨电极)电解Na2SO4溶液来制取H2、O2、H2SO4和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收能量92kJ | B. | 放出能量92kJ | C. | 放出能量30.67kJ | D. | 吸收能量30.67kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com