
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是( )
|
| A. | 水既是氧化剂又是溶剂 |
|
| B. | 放电时正极上有氢气生成 |
|
| C. | 放电时OH﹣向正极移动 |
|
| D. | 总反应为:2Li+2H2O=2LiOH+H2↑ |
考点:
原电池和电解池的工作原理.
专题:
压轴题;电化学专题.
分析:
锂水电池中,自发的氧化还原反应是金属锂和水之间反应生成氢氧化锂和氢气的过程,根据原电池的工作原理以及电极反应特点和规律来回答.
解答:
解:A、金属锂和水之间反应生成氢氧化锂和氢气,该反应中,水是氧化剂,在电池中还可以担当溶剂,故A正确;
B、放电时正极上是水中的氢离子得电子,所以会有氢气生成,故B正确;
C、原电池中,阴离子移向原电池的负极,即放电时OH﹣向负极移动,故C错误;
D、锂水电池中,自发的氧化还原反应是金属锂和水之间反应生成氢氧化锂和氢气,即总反应为:2Li+2H2O=2LiOH+H2↑,故D正确.
故选C.
点评:
本题考查电化学的热点﹣锂离子电池,根据总反应式判断出正负极和阴阳极的反应,从化合价变化的角度分析.


科目:高中化学 来源: 题型:
下列各组离子,能在溶液中大量共存的是( )
|
| A. | H+、Na+、CO32﹣、Cl﹣ | B. | Ba2+、Na+、Cl﹣、SO42﹣ |
|
| C. | K+、H+、SO42﹣、OH﹣ | D. | Ag+、Al3+、NO3﹣、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,有pH=3的醋酸和pH=3的硫酸两种溶液,下列叙述正确的是( )
|
| A. | 两溶液中水电离出的c(H+)=1×10﹣11mol/L |
|
| B. | 加水稀释100倍后两溶液pH仍相同 |
|
| C. | 醋醋中c(CH3COO﹣)与硫酸中的c(SO42﹣)相同 |
|
| D. | 两溶液中分别加入足量锌片放出H2体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在一定温度下的AgCl水溶液中,Ag+和Cl﹣浓度的乘积是一个常数 |
|
| B. | AgCl的Ksp=1.8×10﹣10 mol2•L﹣2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl﹣)且Ag+与Cl﹣浓度的乘积等于1.8×10﹣10 mol2•L﹣2 |
|
| C. | 温度一定时,当溶液中Ag+和Cl﹣浓度的乘积等于Ksp值时,此溶液为 AgCl的饱和溶液 |
|
| D. | 向饱和AgCl水溶液中加入少量盐酸,Ksp值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视.Ⅰ.医学上进行钡餐透视时为什么不用BaCO3? (用离子方程式表示).
Ⅱ.某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水;②40mL 0.2mol•L﹣1Ba(OH)2溶液;③20mL 0.5mol•L﹣1Na2SO4溶液;④40mL 0.1mol•L﹣1H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,Ba2+的浓度由大到小的顺序为 (填字母).
A.②>①>③>④B.②>①>④>③
C.①>④>③>②D.①>②>④>③
(2)已知298K时,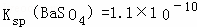 ,上述条件下,溶液②中的
,上述条件下,溶液②中的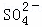 浓度为
浓度为
mol•L﹣1,溶解③中Ba2+的浓度为 mol•L﹣1.
(3)某同学取同体积的溶液②和溶液④直接混合,则混合液的pH为 (设混合溶液的体积为混合前两溶液的体积之和).
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
|
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为有CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl﹣⇌[CuCl4]2﹣+4H2O
蓝色 黄色
现欲使溶液由黄色变成蓝色,请写出一种可采用的方法: .
(2)在2SO2+O2⇌2SO3的平衡体系中,用由18O构成的氧气(18O2)替换掉一部分O2,平衡不发生移动.一段时间后SO2中18O的含量 (填增加、减少或不变),其原因是 .
(3)在恒温恒容的两个密闭容器A和B中,分别加入 a mol 和 b mol 的HI(a>b),发生反应:2HI(g)⇌H2(g)+I2(g)达到平衡后.回答下列问题(用“>”、“<”或“=”填空):
①从反应开始到达到平衡所需要时间:tA tB
②平衡时的碘的浓度:cA(I2) cB(I2)
③HI的平衡转化率:αA αB.
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质中可能有甲醇、甲酸、乙醇、甲酸乙酯几种物质中的一种或几种,在鉴定时有下列现象:①有银镜反应 ②加入新制Cu(OH)2悬浊液,沉淀不溶解,③与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色,下列叙述中正确的是( )
|
| A. | 一定有甲酸乙酯和甲酸 |
|
| B. | 一定有甲酸乙酯和乙醇 |
|
| C. | 一定有甲酸乙酯,可能有甲醇 |
|
| D. | 几种物质都一定有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com