
 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑| A.还原性(酸性溶液):Fe2+> I- > Cl- |
| B.氧化性(酸性溶液):Co(OH)3 >Fe3+ > I2 |
| C.酸性(水溶液):CH3COOH >H2CO3 >HCN |
| D.热稳定性:NaCl>NaClO4>NaClO |
 3NaCl+NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4
3NaCl+NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4 NaCl+2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,故D正确,答案选A。
NaCl+2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,故D正确,答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
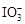 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: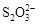 >I-;②KI+I2
>I-;②KI+I2 KI3
KI3| | 0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol·L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②⑥ | C.①③④⑤⑥ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl2>HI>H2SO3>NO | B.H2SO3>HI>FeCl2>NO |
| C.I2>FeCl2>H2SO3>NO | D.NO>FeCl2>H2SO3>HI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.F2、K、HCl | B.Cl2、Al、H2 |
| C.NO2、Na、Br2 | D.O2、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.反应①②③都属于氧化还原反应 |
| B.反应②中氧化剂还原剂均为KClO3,其中氧元素化合价降低 |
| C.反应① H2作还原剂,在反应中被氧化 |
| D.反应①中还原性:H2>Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com