
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
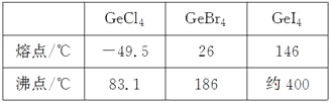
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。
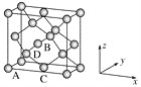
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
【答案】3d104s24p2 2 Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强 O>Ge>Zn sp3 共价键 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)Ge原子半径大,难以通过“肩并肩”方式形成π键;
(3)锗的卤化物都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;
(4)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(5)①Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体;②Ge单晶具有金刚石型结构,则晶胞中Ge原子数目为8,结合阿伏伽德罗常数表示出晶胞的质量,再根据ρ=m/V计算晶胞密度。
(1)锗为32号元素,根据原子核外电子的排布规律,可写出其电子排布式为1s22s22p63s23p63d104s24p2,其核外电子排布简式为[Ar]3d104s24p2,其中4p能级有2个未成对电子,故答案为:3d104s24p2;2;
(2) 虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge的原子半径大,难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或叁键,
故答案为:Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;
(3)由表中数据可知,锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故沸点:GeCl4<GeBr4<GeI4,故答案为:GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强;
(4)Zn、Ge、O三种元素中,Zn和Ge是金属元素,O是非金属元素。O的电负性比Zn和Ge的大,又根据同周期元素的电负性从左到右逐渐增大的规律,可知电负性:O>Ge>Zn,故答案为O>Ge>Zn;
(5)由于锗单晶具有金刚石型的结构,故每个锗原子与相邻的四个锗原子形成四个共价键,其原子轨道杂化类型为sp3杂化,故答案为: sp3 ;共价键;
(6)①由Ge单晶晶胞结构示意图,可知D原子与A原子及位于3个相邻面面心的3个原子构成了正四面体结构,D原子位于正四面体的中心,再根据A、B、C三个原子的坐标参数可知D原子的坐标参数为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );②由锗单晶的晶胞结构示意图,可知该晶胞中位于顶点的有8个原子,位于面心的有6个原子,位于内部的有4个原子,则一个晶胞中所含有的锗原子个数为8×
);②由锗单晶的晶胞结构示意图,可知该晶胞中位于顶点的有8个原子,位于面心的有6个原子,位于内部的有4个原子,则一个晶胞中所含有的锗原子个数为8×![]() +6×
+6×![]() +4=8,再由晶胞参数可知该晶胞的边长为565.76 pm的正方体,则其密度为:
+4=8,再由晶胞参数可知该晶胞的边长为565.76 pm的正方体,则其密度为:![]() ,故答案为:
,故答案为:![]() 。
。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】在有过氧化物存在的条件下,不对称烯烃与HBr加成的反应规律是溴原子加在含氢较多的碳原子上,如: CH3—CH=CH2 + HBr![]() CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
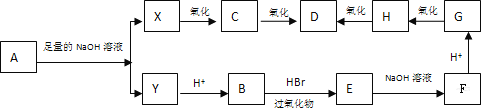
已知:A分子中不含甲基,试回答下列问题:
(1)写出下列物质的结构简式:Y____________、D___________。
(2)写出下列反应的化学方程式:
①A和足量NaOH溶液共热________________________________________;
②B→E ______________________________________________________________;
③X→C ______________________________________________________________;
④X与D发生缩聚反应:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用。铝在下列应用时应加以控制的是
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾与苏打制食品膨松剂
⑥用氢氧化铝凝胶剂加工成胃舒平药片 ⑦易拉罐 ⑧包装糖果和小食品
A. ③⑤⑦⑧ B. ⑥⑦⑧ C. ③⑤⑧ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制备和研究乙炔性质的实验装置图,有关说法不正确的是

A. 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净
B. c(过量)的作用是除去影响后续实验的杂质
C. d、e中溶液褪色的原理不同
D. f处产生明亮、伴有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品中Na2CO3的纯度(质量分数)是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是
A. 等质量的乙烯和丙烯中含有的共用电子对数
B. 等物质的量的水与重水含有的中子数
C. 同温、同压、同体积的CO和NO含有的质子数
D. 等物质的量的铁和铝分别与足量盐酸完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种瑞香素的衍生物的结构简式如图,下列有关该有机物性质的说法正确的是

A. 不能与FeCl3溶液发生显色反应
B. 1 mol该有机物最多可与3 mol H2加成
C. 1 mol该有机物最多可与含5 mol NaOH溶液反应
D. 1 mol该有机物与足量NaHCO3溶液反应可放出3 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的相对分子质量为62。为进一步测定A 的化学式,取3.1g A完全燃烧,得到二氧化碳和水蒸气。将产物先后通过足量的浓硫酸和碱石灰,两者分别增重2.7 g和4.4 g(假设每步反应完全)。
(1)该有机物的实验式是__________________;分子式是________________。
(2)红外光谱显示有“C—C”键和“O—H”键的振动吸收,若核磁共振氢谱只有2个吸收峰且峰面积之比为1∶2,推断该有机物的结构简式是__________________。
(3)该有机物与金属钠反应的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。化合物R是由A、D两元素形成的离子化合物,其中A+阳离子与Dn-阴离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为______________,在CB3分子中C元素原子的原子轨道发生的是______杂化。
(2)C的氢化物的空间构型为________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________________________________________________________。
(3)B元素的电负性____D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:________________________________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为_________________。(阿伏加德罗常数用NA表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com