
| A. | 都正确 | B. | ②③④⑤ | C. | ②⑤⑥ | D. | ④⑤⑥ |
分析 ①碱性氧化物与水反应只生成碱;
②依据离子反应条件判断;
③镁与氧气反应生成氧化镁,与氮气反应生成氮化镁;
④过氧化钠与水、二氧化碳反应都生成氧气;
⑤过氧化钠具有漂白性,与水反应生成碱氢氧化钠;
⑥钠与盐溶液反应先与水反应,生成的氢氧化钠再与盐发生复分解反应.
解答 ①过氧化钠与水反应生成氢氧化钠和氧气,不属于碱性氧化物,故不选;
②碳酸氢钠与氯化钙不符合离子反应发生条件,不反应,故不选;
③镁与空气反应生成氧化镁和氮化镁,故不选;
④过氧化钠与水、二氧化碳反应都生成氧气,可做供养剂,氧化钠不具有此性质,故选;
⑤过氧化钠具有漂白性,与水反应生成碱氢氧化钠和氧气,所以向石蕊试液中加入Na2O2粉末,溶液先变蓝后褪色,并有气泡生成,故选;
⑥钠与浓NH4Cl溶液反应,先与水反应生成氢氧化钠和氢气,氢氧化钠再与氯化氨反应生成氨气,所以放出的气体中含H2和NH3,故选;
故选:D.
点评 本题考查元素化合物知识,明确钠及其化合物的性质是解题关键,注意碱性氧化物的概念,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | I- | B. | HCO${\;}_{3}^{-}$ | C. | Cl- | D. | NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
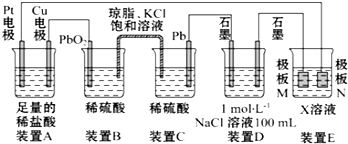
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Fe参与负极反应,NiO2参与正极反应 | |
| B. | 充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 蓄电池的电极必须浸入某种碱性电解质溶液中 | |
| D. | 放电时,电解质溶液中的阴离子向正极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14% | B. | 16% | C. | 11% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
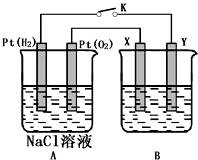 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g金属铁与一定量的硝酸反应时失去的电子数一定为3NA | |
| B. | 2mol SO2和1mol O2在密闭容器中加热(V2O5催化) 充分反应后,容器内分子总数为2NA | |
| C. | 1mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com