
| A. | 酸性:H2SO4>H3PO4>H2SiO3 | B. | 还原性:Cl->Br->I- | ||
| C. | 氧化性:Na+<Mg2+<Al3+ | D. | 沸点:H2O<H2S<H2Se |
分析 A.根据元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强;B.单质的氧化性越强则离子的还原性越弱;C.元素的金属性越强,其对应最高价阳离子的氧化性越弱;D.含有氢键的沸点较高.
解答 解:A.因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:S>P>Si,
酸性:H2SO4>H3PO4>H2SiO3,故A正确;B.元素单质氧化性Cl2>Br2>I2,则离子的还原性顺序:Cl-<Br-<I-,故B错误;mC.由于金属性Na>Mg>Al,所以金属离子的氧化性:Na+<Mg2+<Al3+,故C正确;D.同主族元素的氢化物,随着原子序数的递增,熔沸点逐渐升高,但是由于水中存在氢键,所以水的熔点最高,故D错误,故选AC.
点评 本题考查学生元素周期律的应用知识,可以根据所学知识进行回答,难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体 | B. | Fe(OH)3沉淀 | C. | FeCl3溶液 | D. | 油水混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
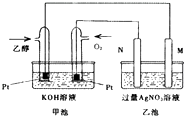 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
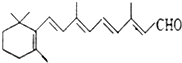 人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )
人们能够在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”的有机化合物,其结构简式如图所示,下列有关视黄醛的说法正确的是( )| A. | 视黄醛的分子式为C20H27O | |
| B. | 视黄醛可以使溴水和酸性高锰酸钾溶液褪色,也能发生银镜反应 | |
| C. | 视黄醛分子结构中含有苯环、碳碳双键和醛基 | |
| D. | 1mol视黄醛在催化剂的作用下最多可与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是原子间的相互作用 | |
| B. | 离子键是阴阳离子间的静电吸引 | |
| C. | 化学键被破坏的变化一定是化学变化 | |
| D. | 共价化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
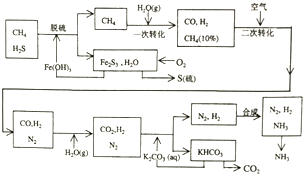
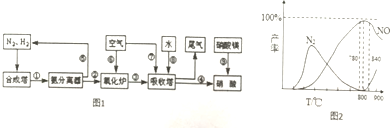
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的氧化性逐渐减弱 | B. | 单质的熔、沸点逐渐降低 | ||
| C. | 单质的密度逐渐降低 | D. | 气态氢化物的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
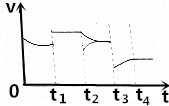 如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )
如图是反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应速率随时间的变化图象,在t1时反应达到平衡状态,然后改变一个条件,v正的变化如图所示,则下列说法正确的是( )| A. | t1时改变的条件是增大压强,且平衡没有移动 | |
| B. | t2时改变的条件时减小甲醇的浓度,且平衡正向移动 | |
| C. | t2时改变的条件是增大了氢气的浓度,且平衡正向移动 | |
| D. | t3是改变的条件是升高温度,且平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
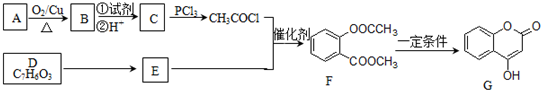


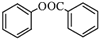 )的合成路线流程图(无机原料任用).
)的合成路线流程图(无机原料任用).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com