
【题目】A是一种重要的化工原料,部分性质及转化关系如下图:

请回答:
(1)D中官能团的名称是_____________。
(2)A→B的反应类型是________________。
A.取代反应B.加成反应 C.氧化反应 D.还原反应
(3)写出A→C反应的化学方程式_______________________。
(4)某烃X与B是同系物,分子中碳与氢的质量比为36:7,化学性质与甲烷相似。现取两支试管,分别加入适量溴水,实验操作及现象如下:
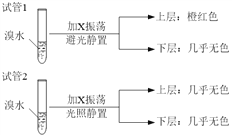
有关X的说法正确的是_______________________。
A.相同条件下,X的密度比水小
B.X的同分异构体共有6种
C.X能与Br2发生加成反应使溴水褪色
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
【答案】 羧基 BD CH2=CH2+H2O![]() CH3CH2OH AD
CH3CH2OH AD
【解析】C与D反应生成乙酸乙酯,则C、D分别为乙酸、乙醇中的一种,A与水反应生成C,A氧化生成D,且A与氢气发生加成反应生成B,可推知A为CH2=CH2,与水在一定条件下发生加成反应生成C为CH3CH2OH,乙烯氧化生成D为CH3COOH,乙烯与氢气发生加成反应生成B为CH3CH3。
(1)D为CH3COOH,含有的官能团为羧基,故答案为:羧基;
(2)A→B是乙烯与氢气发生加成反应生成乙醇,也属于还原反应,故选:BD;
(3)A→C反应的化学方程式:CH2=CH2+H2O![]() CH3CH2OH,故答案为:CH2=CH2+H2O
CH3CH2OH,故答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(4)某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为![]() :
:![]() =3:7=6:14,故X为C6H14。A.相同条件下,C6H14的密度比水小,故A正确;B.C6H14的同分异构体有己烷、2-甲基戊烷、3-甲基戊烷、2,3-二甲基丁烷、2,2-二甲基丁烷,共5种,故B错误;C.X为烷烃,不能与溴发生加成反应,故C错误;D.发生取代反应得到溴代烃,与水不互溶,可以可通过加水确定试管2中的有机层是上层还是下层,故D正确;故选AD。
=3:7=6:14,故X为C6H14。A.相同条件下,C6H14的密度比水小,故A正确;B.C6H14的同分异构体有己烷、2-甲基戊烷、3-甲基戊烷、2,3-二甲基丁烷、2,2-二甲基丁烷,共5种,故B错误;C.X为烷烃,不能与溴发生加成反应,故C错误;D.发生取代反应得到溴代烃,与水不互溶,可以可通过加水确定试管2中的有机层是上层还是下层,故D正确;故选AD。


科目:高中化学 来源: 题型:
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( ) 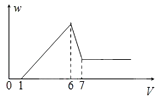
A.2:3
B.1:1
C.4:3
D.8:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)氧化还原反应的本质是 , 通常可用元素化合价的升降来判断氧化剂、还原剂.所含元素化合价升高的物质是剂,发生反应.
(2)写出用稀氢氧化钠吸收氯气反应的离子方程式:
(3)0.1mol/L的Na2CO3溶液的含义是(填字母)
A.1L水中含有0.1mol Na2CO3
B.1L溶液中含有10.6g Na2CO3
C.将10.6g Na2CO3溶于1L水配成的溶液
D.1L溶液中含有0.2mol Na+
(4)关于钠及其化合物的叙述正确的是(填字母)
A.钠元素在自然界中都是以化合态存在
B.钠着火时可以用湿布盖灭
C.实验室少量的钠应保存在煤油或石蜡油中
D.实验中剩余的过氧化钠粉末可以用纸包裹好后,放入垃圾桶内
(5)下列反应的离子方程式书写不正确的是(填字母)
A.氯化钙溶液与碳酸钠溶液反应:Ca2++CO32﹣=CaCO3↓
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42﹣=BaSO4↓
C.氢氧化镁与稀盐酸反应:Mg(OH)2+2H+=Mg2++2H2O
D.氢氧化钡溶液与盐酸的反应:OH﹣+H+=H2O
E.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
F.碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .合成氨工业在现代农业、国防工业中,有着重要的地位
己知:N2 (g) +3H2 (g) ![]() 2NH3 (g) △H=-92 kJ·mol-1
2NH3 (g) △H=-92 kJ·mol-1
(1)下列有关该反应速率的叙述,正确的是(选填序号)____________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量—定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)对于合成氨反应而言,如图有关图象一定正确的是(选填序号) ______________。

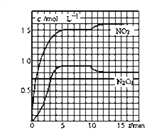
II.向2L的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:
①2NO(g) + O2(g) =2NO2 (g) ②2NO2 (g) ==N2O4 (g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。
(1)计算前5min N2O4反应的平均速率为________________________。
(2)计算T1℃时反应②的化学平衡常数为_______________________。
(3)若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,判断T1℃时反应②进行的方向_____(正向、逆向、不移动),并计算达到平衡时N2O4的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种物质: ①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 其中能使酸性高锰酸钾溶液褪色的是( )
A.① ②B.④ ⑤C.③ ④D.③ ⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com