
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
| 选项 | 目 的 | 实验方法 |
| A | 除去Na2CO3固体中的NaHCO3 | 置于坩埚中加热至恒重 |
| B | 除去NaCl中少量KNO3 | 将混合物制成热饱和溶液,冷却结晶,过滤 |
| C | 除去CO2中的HCl气体 | 通过NaHCO3(aq,饱和),然后干燥 |
| D | 除去C2H5Br中的Br2 | 加入足量Na2SO3(aq),充分振荡,分液 |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )①CH2=CHCH3 ②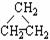 ③CH3CH2CH3 ④HC
③CH3CH2CH3 ④HC CCH3 ⑤
CCH3 ⑤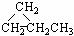 ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3
A.①和② B.①和③ C.①和④ D.⑤和⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温下,1 mol Cl2与足量NaOH溶液完全反应,转移的电子数2NA
B.常温常压下,11.2 L CO2中含有的分子数是0.5NA
C.标准状况下,22.4 L水所含原子数为3NA
D.常温常压下,48 g O3和O2的混合气体中氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
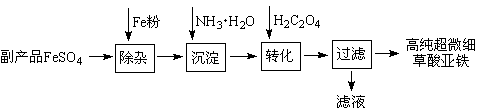
已知:①5Fe2++ MnO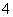 +8H+=5Fe3+ +Mn2++4H2O
+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO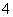 +16H+=10CO2↑+2Mn2++8H2O
+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 ▲ 。
(2)滤液经处理可得到副产品 ▲ 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 ▲ 。(写出计算过程)
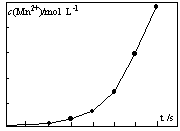
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如右图,其变化趋势的原因可能为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K= ;
根据右图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化 b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变 d、 v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少 b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加 d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该 化学反应过程的能量变化(标明信息)。
 (6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构
 如右图所示,下列说法正确的是
如右图所示,下列说法正确的是
A. 该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1 mol该有机物最多能与2 molH2发生加成反应
D.该有机物的一种芳香族同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.过氧化钠投入水中: 2Na2O2 + 2H2O=4Na+ + 4OH-+ O2↑
B.二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O
C.碳酸钙溶于盐酸 CO32- + 2H+=H2O + CO2↑
D.向氯化亚铁溶液中滴入氯水: Fe2+ + Cl2=Fe3++ 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素, 它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍, W与Y可形成化合物W2Y。下列说法正确的是
A.Y的低价氧化物与O3漂白的原理相同
B.Y的氢化物和W2Y所含化学键的类型相同
C.上述三种元素形成的简单离子,X离子半径最小
D.工业上常用电解相应的盐溶液制备W、X的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com