
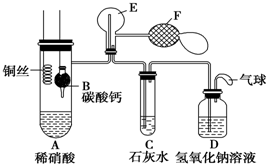
 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.分析 Ⅰ、要验证铜与稀硝酸反应生成一氧化氮,则应将装置中的O2排出.当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,但由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深.随着反应的不断进行,E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解.D装置用来吸收尾气,防止污染环境.
Ⅱ、反应①中I元素化合价由+5价降低到0价,被还原,IO3-为氧化剂,S元素化合价由+4价升高到+6价,被氧化,HSO3-为还原剂;
反应②I元素化合价由0价降低到-1价,I2为氧化剂,S元素化合价由+4价升高到+6价,被氧化,HSO3-为还原剂,以此解答该题.
解答 解:Ⅰ、(1)当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,以防止氧化生成的NO,
故答案为:产生二氧化碳,排出装置中的空气;
(2)A中产生无色气体为NO,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深,
故答案为:二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮;
(4)E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解,
故答案为:二氧化氮与水反应生成硝酸,硝酸使白色沉淀碳酸钙溶解;
(5)D装置用来吸收尾气,防止污染环境,故答案为:吸收尾气,防止污染大气.
Ⅱ、反应①中I元素化合价由+5价降低到0价,被还原,IO3-为氧化剂,S元素化合价由+4价升高到+6价,被氧化,HSO3-为还原剂,反应的离子方程式为2IO3-+5HSO3-=I2+5SO42-+3H++H2O,
(1)反应①中I元素化合价由+5价降低到0价,被还原,IO3-为氧化剂,S元素化合价由+4价升高到+6价,被氧化,HSO3-为还原剂,反应的离子方程式为2IO3-+5HSO3-=I2+5SO42-+3H++H2O,
故答案为:2,5,1,5,1,3H+;
(2)由反应①可知还原性HSO3->I2,由反应②可知还原性HSO3->I-,而还原性I->I2,则有HSO3->I->I2,
故答案为:HSO3->I->I2;
(3)n(KIO3)=0.01L×0.2mol/L=0.002mol,由方程式可知关系式为:KIO3~3NaHSO3,需要0.006molNaHSO3反应,则溶液体积为$\frac{0.006mol}{0.3mol/L}$=0.02L=20mL,
故答案为:20ml;
(4)由反应的方程式可以看出向含有淀粉的NaHSO3溶液滴加KIO3溶液,发生6HSO3-+2IO3-+3H2O=2I-+6SO42-+6H+,然后发生IO3-+5I-+6H+=3I2+3H2O,可观察到一开始无明显现象后变蓝,
答:一开始无明显现象后变蓝.
点评 本题综合考查物质的性质实验探究,涉及硝酸与铜的反应以及一氧化氮的性质,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| B. | 镀锡铁皮的镀层损坏后,铁更容易腐蚀 | |
| C. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| D. | 钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | B. | 分别加热,观察是否生成沉淀 | ||
| C. | 加入淀粉酶观察是否水解 | D. | 分别加入KI溶液,观察颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1mol/L CH3COONa溶液中存在NA个CH3COO-离子 | |
| B. | 在标准状况下,22.4LSO3含有3NA个氧原子 | |
| C. | 1 mol Cl2参加化学反应获得的电子数都是2NA | |
| D. | 1 mol NO2气体降温后颜色变浅,其所含的原子数仍为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和水反应吸收131.3kJ能量 | |
| B. | 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 | |
| C. | 在298K时,1mol碳(s)和1molH2O(g)反应生成CO(g)和H2(g),吸热131.3kJ | |
| D. | 1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com