
����Ŀ����ش��������⣺
��1����ͼ��ʾ����һ��С�ձ��������ϸ��20g Ba��OH��28H2O���壮����С�ձ��������ȵ���3��4��ˮ�IJ���Ƭ�ϣ�Ȼ����С�ձ��м���10g NH4Cl���壬���ò��������ٽ��裮 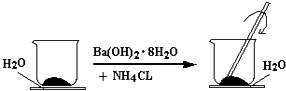
��ʵ���в�������������
��д���йط�Ӧ�Ļ�ѧ����ʽ����
���Ĵ������Ӧ���ͷ������÷�Ӧ��������
��ʵ���������˵���÷�Ӧ�ķ�Ӧ���������������ڡ���С�ڡ����������������
��2��������δ�����������Դ֮һ����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼�����2H2O ![]() 2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ� �Իش��������⣺
2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ� �Իش��������⣺
�ٺ�ˮ�ֽ����ɵ���������ȼ�ϵ��ʱ��ʵ����ת��Ϊ�ܣ�ˮ�ֽ�ʱ�����ѵĻ�ѧ��Ϊ�����ֽ⺣ˮ�ķ�Ӧ������Ӧ������ȡ������ȡ�����
��ij������ȼ�ϵ�����ù�������������մ�������ʣ������Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��A����2H2+2O2����4e���T2H2O��B����O2+4e���T2O2�� �� ��A���ǵ�ص��������ӴӸü�������롱������������
�������Ի�ѧ��Ӧ��2Zn+O2+4H+�T2Zn2++2H2OΪ������Ƴ�һ��ԭ��أ�������������Ϊ������������Դ�����ǿ�������ѪҺ������һ��Ũ�ȵ�O2��H+��Zn2+���й�������ԭ��صĸ����Ϸ�����Ӧ�ĵ缫��ӦʽΪ ��
��3����������ȼ�չ����У��ƻ�1molH2�еĻ�ѧ�����ĵ�����ΪQ1kJ���ƻ�1molO2�еĻ�ѧ��ΪQ2kJ���γ�1molH2O�еĻ�ѧ���ͷŵ�����ΪQ3 �� ���й�ϵʽ��ȷ����
A.Q1+Q2��Q3
B.Q1+Q2��Q3
C.2Q1+Q2��2Q3
D.2Q1+Q2��2Q3 ��
���𰸡�
��1�����裬ʹ������ֽӴ���Ba��OH��2?8H2O+2NH4Cl�TBaCl2+2NH3��+10H2O�����ֽ⣻С��
��2����ѧ���磻���ۣ����ȣ�����������Zn��2e��=Zn2+
��3��D
���������⣺��1����ʵ���в������������ǽ���ʹ��Ӧ���ֽӴ�����Ӧ�����Դ��ǣ����裬ʹ������ֽӴ������Ȼ��������Σ��ܺ�ǿ�����������������ֽⷴӦ�����ɰ�����ˮ���Լ��Ȼ�������ѧ����ʽΪBa��OH��28H2O+2NH4Cl=BaCl2+2NH3��+10H2O�����Դ��ǣ�Ba��OH��28H2O+2NH4Cl=BaCl2+2NH3��+10H2O�����ֽ⣻�۲���Ƭ�Ͻ������С�ձ�ճ��һ��˵�������������Ȼ�淋ķ�Ӧ�����ȷ�Ӧ������Ӧ���������С��������������������Դ��ǣ�С�ڣ���2����ˮ���Էֽ⣬ˮ�����д��ڹ��ۼ����ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ����������ü����ṩ��������˵�������������������ã��÷�Ӧ���ȣ�ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã����Դ��ǣ���ѧ���磻���ۣ����ȣ����������л�ԭ�ԣ��ڸ����ϱ�������ʧȥ���ӣ����ӴӸ��������·�������������Դ��ǣ�������������ԭ��ظ���ʧȥ���ӣ����ϼ����ߣ�����������Ӧ�������ܷ�Ӧʽ2Zn+O2+4H+�T2Zn2++2H2O���õ�������ӦΪ��Zn��2e��=Zn2+ �� ���Դ��ǣ�Zn��2e��=Zn2+����3���ƻ�1molH��H���ĵ�����ΪQ1kJ����H��H����ΪQ1kJ/mol���ƻ�1molO�TO�����ĵ�����ΪQ2kJ����O�TO������ΪQ2kJ/mol���γ�1molˮ�еĻ�ѧ���ͷŵ�����ΪQ3kJ��ÿĦ��H2O�к���2molH��O����1molH��O���ͷŵ�����Ϊ ![]() Q3kJ����H��O����Ϊ
Q3kJ����H��O����Ϊ ![]() Q3kJ/mol�����ڷ�Ӧ2H2��g��+O2��g���T2H2O��l����Ӧ�ȡ�H=��Ӧ����ܼ��ܩ���������ܼ��ܣ����Է�Ӧ�ȡ�H=2Q1kJ/mol+Q2kJ/mol��4��
Q3kJ/mol�����ڷ�Ӧ2H2��g��+O2��g���T2H2O��l����Ӧ�ȡ�H=��Ӧ����ܼ��ܩ���������ܼ��ܣ����Է�Ӧ�ȡ�H=2Q1kJ/mol+Q2kJ/mol��4�� ![]() Q3kJ/mol=��2Q1+Q2��2Q3��kJ/mol������������������ȼ�գ���Ӧ�ȡ�H��0������2Q1+Q2��2Q3����0������2Q1+Q2��2Q3 �� ���Դ��ǣ�D��
Q3kJ/mol=��2Q1+Q2��2Q3��kJ/mol������������������ȼ�գ���Ӧ�ȡ�H��0������2Q1+Q2��2Q3����0������2Q1+Q2��2Q3 �� ���Դ��ǣ�D��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�����֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ�����ȷ�����⣮


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڱ仯�����У���ѧ��û�б��ƻ����� ( )
A. ʳ���ܽ�B. �ɱ�����
C. �Ȼ�����ȣ�������ʧD. ���ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ģ����ҵ�Ժ�����ˮ��Cr2O72����Cr3+������������ͼ1 
��֪��2CrO42��+2H+�TCr2O72��+H2O
��ش�
��1�������ӷ���ʽ��ʾ���ڳ�����ķ�Ӧ�� ��
��2��������õ��IJ����Ļ�ѧʽΪ ��
��3�����������pHʱ���ʺ���Ϊ���ڼ����� ��
A.4molL��1����
B.6molL��1����
C.ʯ����
D.̼����
��4��Ϊ�������ˮ�и��ĺ�����ȡ100mL���������Ʒ����ƿ�У���Ũ�������pH=5���������������忹��Ѫ�ᣬʹCr2O72����ȫת��ΪCr3+ �� ����amolL��1��EDTA����H4Y��ʾ������Һ���еζ����䷴Ӧԭ��Ϊ��Cr2O72����2Cr3+ �� Cr3++Y4��=CrY��
�ٵζ�ʱ������ͼ2��ʾ�IJ���Զ�����λ�ζ��ܣ����е��ŵ��� ��
��ʵ������EDTA����Һb mL���������Һ�к���Ũ��ΪmgL��1���ú�a��b��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��ǻ�ѧѧϰ�Ĺ��ߣ���ͼ��þԪ�������ڱ��еı�ʾ�������й�þԪ����Ϣ����ȷ���ǣ� �� 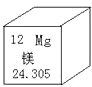
A.ԭ��������12
B.���ǽ���Ԫ��
C.ԭ�ӽṹʾ��ͼΪ ![]()
D.þԪ���ڵؿ��еĺ���Ϊ24.305%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ԣ�Br2��Fe3+��I2 �� ��a mol FeI2����Һ�м��뺬b mol Br2����ˮ����ַ�Ӧ������˵������ȷ���ǣ� ��
A.���ӵĻ�ԭ��ǿ����I����Fe2+��Br��
B.��a��bʱ�����������ӷ�Ӧ��2I��+Br2�TI2+2Br��
C.��5a=4bʱ����Ӧ�������Ũ��֮�ȣ�c��Fe2+����c��Fe3+����c��Br����=1��1��5
D.��3a��2bʱ�����������ӷ�Ӧ��2Fe2++2I��+2Br2�T2Fe3++I2+4Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ��Ʊ����죬���������������� 
��ش�
��1������ҺA �к���Fe2+�ķ����� ��
��2����ҺA��B������Ӧ�����ӷ���ʽΪ ��
��3���ڿ���������FeCO3�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Na2CO3��NaHCO3�ľ��Ȼ����ֳɵ��������ݣ������е�һ��ֱ�Ӽ��������أ�����������1.24g����һ�ݼ���һ������ijŨ�ȵ�������ǡ�÷�Ӧ��ȫ���ռ�����״����2.24L���壬��������40.0mL���Լ��㣺
��1��ԭ���Ȼ������NaHCO3�����ʵ�����n��NaHCO3��=mol��
��2�������Ũ��c��HCl��=mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����һ�ּ����Ԫ�أ����й���蘆���������ȷ���� ( )
A. ����̼��錄���������鷺Ͷ�����̼
B. ��ڿ�����ȼ�����������һ��������
C. ���ˮ��Ӧ���ܷ�����ը�����ų�����
D. ���������һ�ֿ�����ˮ��ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D����Ԫ�أ���֪AԪ��ԭ�ӵĵ�һ��͵������������ͬ��BԪ��ԭ�ӵĵڶ���ȵ�һ���������5����CԪ�ص�+3�������Ӻ���ԭ�Ӿ�����ͬ�ĵ�������DԪ�ص�ԭ�Ӻ�����4�����Ӳ㣬��һ����ڶ��������֮�͵��ڵ���������IJ������֮�ͣ�д����
��1��Ԫ�ط��ţ�A �� B �� C �� D ��
��2��A��D��ԭ�ӽṹʾ��ͼ�� �� C�����ӽṹʾ��ͼ
��3��������AB2�ĵ���ʽ��ѧ������Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com