
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 将标准状况下112mL氯气通入10mL 1mol•L-1的溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3+CO32-+2H2O |
分析 A.氢氧化钡过量,离子方程式按照明矾的化学式书写,铝离子反应生成偏铝酸根离子;
B.溶液为中性,则硫酸氢钠与氢氧化钡按照物质的量2:1反应;
C.亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应,先判断过量,根据过量情况判断反应产物;
D.碳酸氢钙和氢氧化钠的物质的量相等,氢氧化钠不足,反应生成碳酸钙沉淀、碳酸氢钠和水.
解答 解:A.向明矾溶液中加入过量的氢氧化钡溶液,反应生成偏铝酸钠、硫酸钡沉淀和水,反应的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故A正确;
B.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性,则氢离子与氢氧根离子的物质的量相等,反应生成硫酸钠和硫酸钡,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B错误;
C.将标准状况下112mL氯气的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,10mL 1mol•L-1的溴化亚铁溶液中含有溴化亚铁0.01mol,0.01mol溴化亚铁最多消耗0.015mol氯气,显然氯气不足,亚铁离子的还原性大于溴离子,亚铁离子优先反应,0.01mol亚铁离子消耗0.005mol氯气,氯气恰好完全反应,溴离子没有参与反应,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C错误;
D.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合,氢氧化钠不足,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3+H2O,故D错误;
故选A.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;C为易错点,注意明确反应物过量情况及还原性强弱.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔点高,有滑腻感,可用于制润滑剂 | |
| B. | 质软,在纸上划过留痕迹,可用于制铅笔芯 | |
| C. | 有良好的导电性,可用于制干电池的电极 | |
| D. | 耐高温,可用于制作刻划玻璃的工具 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
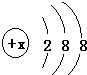 有几种元素的微粒的电子层结构如图所示,其中:
有几种元素的微粒的电子层结构如图所示,其中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钡与盐酸反应:BaSO3+2H+=Ba2++SO2↑+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-=HCO${\;}_{3}^{-}$ | |
| C. | 澄清石灰水跟盐酸反应:H++OH-=H2O | |
| D. | 亚硫酸氢钠溶液与NaOH溶液反应:HSO${\;}_{3}^{-}$+OH-=SO${\;}_{3}^{2-}$+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可鉴别苯、CCl4、苯乙烯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 向液态溴苯中加入硝酸银溶液,观察有无淡黄色沉淀生成,以检验溴元素的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.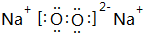 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com