
福岛核电站泄漏的放射性物质中含有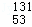 I,下列有关
I,下列有关 I的说法正确的是( )
I的说法正确的是( )
|
| A. |
|
|
| B. | 由此可确定碘元素的相对原子质量为131 |
|
| C. |
|
|
| D. |
|
考点:
同位素及其应用;质量数与质子数、中子数之间的相互关系.
专题:
原子组成与结构专题.
分析:
 I的质子数位53,质量数为131,质子数+中子数=质量数,则该碘原子的中子数=131﹣53=78;具有相同质子数而中子数不同的同种元素的原子互为同位素,该碘原子为碘元素的一种同位素;摩尔质量的单位为g/mol,该碘单质的摩尔质量为262g/mol,据此进行解答.
I的质子数位53,质量数为131,质子数+中子数=质量数,则该碘原子的中子数=131﹣53=78;具有相同质子数而中子数不同的同种元素的原子互为同位素,该碘原子为碘元素的一种同位素;摩尔质量的单位为g/mol,该碘单质的摩尔质量为262g/mol,据此进行解答.
解答:
解:A.具有相同质子数而中子数不同的同种元素的原子互为同位素,该碘原子为碘元素的不同核素,即该碘原子为碘元素的一种同位素,故A正确;
B.该碘原子的相对原子质量为131,而碘元素的相对原子质量与各同位素原子的含量有关,需要根据各同位素的含量进行计算,故B错误;
C. I的质子数位53,质量数为131,含中子数为131﹣53=78,故C错误;
I的质子数位53,质量数为131,含中子数为131﹣53=78,故C错误;
D.该碘单质的相对分子量为262,其摩尔质量为262g/mol,故D错误;
故选A.
点评:
本题考查了同位素、原子结构、摩尔质量与质量、相对分子量的关系,题目难度不大,注意掌握同位素、摩尔质量的概念,明确原子中质量数=质子数+中子数,选项B为易错点,注意元素的相对原子量与该元素的各种核素的含量有关.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
下列物质中氧原子数目与93g Na2O中氧原子数一定相等的是( )
|
| A. | 67.2L CO2 | B. | 33g CO2 | C. | 80g SO3 | D. | 98g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是:( )
A.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42—+20H+ = 4Fe3++3O2↑+10H2O
B.10mL0.5mol/L的明矾溶液与20mL0.5mol/LBa(OH)2溶液混合反应:
3Ba2+ + 6OH- +2Al3+ +3SO42- = 3BaSO4↓+2Al(OH)3↓
C.铜粉与63%的硝酸反应:Cu +4H++2NO3- =Cu2++2 NO2↑+ 2H2O
D.工业上用纯碱液吸收SO2:CO32-+SO2=CO2+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
央广网北京消息,据中国之声《央广新闻》报道,雾霾天气今起再次正面袭扰京津冀等地,部分地区有中到重度霾。解决环境问题需要化学知识,化学与生活联系紧密,下列说法正确的是
A.我国重点城市近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物
B.PM 2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
D.绿色化学的核心是利用化学原理对环境污染进行治理
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D为原子序数依次增大的前四周期元素,元素A基态原子核外有3个未成对电子,元素B原子最外层电子数是内层电子数的3倍,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB 的空间构型为________。
的空间构型为________。
(2)元素A、C形成的化合物熔点高,但比B、C形成的化合物熔点低,其原因是 。
 (3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是________。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是________。
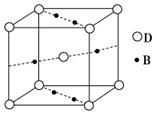
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,
其晶胞如右图所示。该化合物的化学式为________。
(5)向D的氯化物DCl3溶液中滴加氨水可形成配合Cl
①D原子的外围电子排布式为________。
②1 mol该配合物中含配位键的数目为________。
(6) D元素以D2O 的形式存在于酸性废水中,常用FeSO4将其还原为D3+,写出该反应的离子方程式为___________________________________________。
的形式存在于酸性废水中,常用FeSO4将其还原为D3+,写出该反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程属于取代反应的是( )
|
| A. | 苯与碘水混合振荡,水层颜色变浅发生萃取 |
|
| B. | 乙烯使溴水褪色 |
|
| C. | 甲烷与氯气光照下反应 |
|
| D. | 乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
|
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) |
|
| C. | v(C)=0.4mol/(L•min) | D. | v(D)=0.0075 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是______________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是________________。
6Cu+SO2↑,反应的氧化剂是________________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是_______________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称_________________。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:___________________________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表面易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D. | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com