
 、
、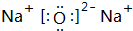 .
. .
. 分析 A、B、C、D、E为元素周期表中前三周期的主族元素,它们的原子序数按A、B、C、D、E的顺序增大.A的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;C与E最外层电子数相等,二者处于同主族,D与C可形成D2C、D2C2两种离子化合物,则D为Na、C为O,形成的两种离子化合物为Na2O、Na2O2,则E为S元素,E的最高价氧化物为SO3,含氧为$\frac{48}{80}$×100%=60%,符合题意,B原子序数介于碳、氧之间,故B为N元素,据此解答.
解答 解:A、B、C、D、E为元素周期表中前三周期的主族元素,它们的原子序数按A、B、C、D、E的顺序增大.A的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;C与E最外层电子数相等,二者处于同主族,D与C可形成D2C、D2C2两种离子化合物,则D为Na、C为O,形成的两种离子化合物为Na2O、Na2O2,则E为S元素,E的最高价氧化物为SO3,含氧为$\frac{48}{80}$×100%=60%,符合题意,B原子序数介于碳、氧之间,故B为N元素.
(1)由上述分析可知,A为C元素、B为N元素、C为O元素、D为Na、E为S元素,
故答案为:C;N;O;Na;S;
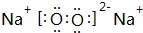
(2)Na2O2的电子式为 ,Na2O的电子式为
,Na2O的电子式为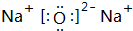 ,
,
故答案为: ;
;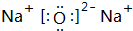 ;
;
(3)用电子式表示CO2化合物的形成过程为: ,
,
故答案为: .
.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,注意掌握用电子式表示化学键或物质的形成.


科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:1 | B. | 3:2:3 | C. | 2:5:2 | D. | 1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
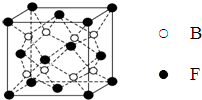 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)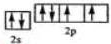 ;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族
;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族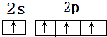 ,不符合能量最低原理原理.
,不符合能量最低原理原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 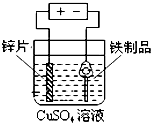 铁制品表面镀锌 | B. | 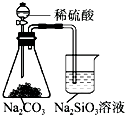 验证碳酸酸性强于硅酸 | ||
| C. | 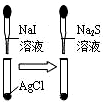 说明溶解性AgCl<AgI<Ag2S | D. |  浸在冷水中的玻璃球颜色较深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com