
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用太阳能、潮汐能、风力发电,以获取清洁能源 | |
| C. | 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 大量排放SO2,NO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  此图表示可用蒸馏法分离X、Y | B. |  SO2气体通入溴水中 | ||
| C. |  氨气通入醋酸溶液中 | D. | 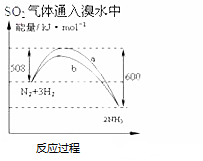 N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子数目为0.5NA | |
| B. | 常温下,1.8g水中含有的电子数为NA | |
| C. | 0.1 mol Cl2与足量氢氧化钠溶液反应,转移的电子数为0.2NA | |
| D. | 1L0.1mol/L的NH4CL溶液中含NH4+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 草酸氢钾溶液呈酸性,在0.1mol•L-1KHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | 相同温度下,1 mol•L-1氨水溶液与0.5mol•L-1氨水溶液中,c(OH-)之比是2:1 | |
| D. | 当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液存放在橡皮塞的试剂瓶中 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体和浊液 | |
| D. | 向石蕊试液中加入新制氯水,石蕊试液只变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com