
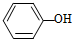
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
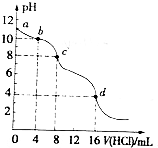 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.测得混合溶液的pH随所加盐酸体积的变化曲线如图(已知饱和CO2溶液pH为3.9),下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | myX | B. | y+myX | C. | y+nm+y+nX | D. | y+ny+m-n× |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于有机物M的说法正确的是( )
关于有机物M的说法正确的是( )| A. | 有机物M的分子式为C10H12O3 | |
| B. | 1 mol Na2CO3最多能消耗1 mol有机物M | |
| C. | 1 mol M和足量金属钠反应生成22.4 L气体 | |
| D. | 有机物M能发生取代、氧化、还原和加聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com