
【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
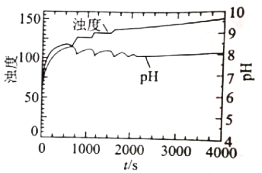
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
【答案】沉淀颗粒过大 > ![]()
![]()
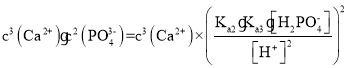 =
= ,不能生成沉淀 A
,不能生成沉淀 A
【解析】
(1)试验目的是制备纳米磷酸钙,若搅拌速率降低,可能形成的固体颗粒较大,
故答案为:沉淀颗粒过大;
(2)由电荷守恒可知:![]() ,溶液呈碱性,故c(OH-)>c(H+),故c(
,溶液呈碱性,故c(OH-)>c(H+),故c(![]() )> c(
)> c(![]() ),
),
故答案为:>;
(3)①Na3PO4溶液与盐酸反应生成NaH2PO4,其离子方程式为:![]() ,
,
故答案为:![]() ;
;
②![]() 的水解常数Kh=
的水解常数Kh=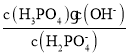 =
=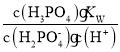 =
=![]() =1.3×10-12<Ka2,
=1.3×10-12<Ka2,![]() 电离出的
电离出的![]() 较低,故
较低,故![]() 浓度最小,故含磷微粒浓度从大到小的顺序为:
浓度最小,故含磷微粒浓度从大到小的顺序为:![]() ,
,
故答案为:![]() ;
;
③Qsp=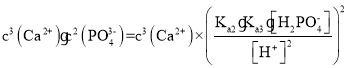 =
= ,不能生成沉淀,
,不能生成沉淀,
故答案为:Qsp=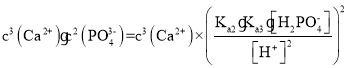 =
= ,不能生成沉淀;
,不能生成沉淀;
(4)A、振荡周期内,溶液的pH会发生变化,![]() 浓度受到溶液酸碱度的影响也会发生相应的变化,故A符合题意;
浓度受到溶液酸碱度的影响也会发生相应的变化,故A符合题意;
C、随着磷酸钙沉淀的生成,磷酸根浓度逐渐减小,其水解量逐渐减小,溶液的碱性逐渐降低,pH会下降,故C不符合题意;
D、尿素水解导致溶液呈碱性,磷酸水解导致溶液呈碱性,但二者的速率可能存在差异,因此会导致pH周期性振荡,故D不符合题意;
故答案为:A。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1)铜原子核外电子共有______种不同运动状态,基态铜原子的核外占据最高能层电子的电子云轮廓图形状为______。
(2)根据铜、锌原子结构可知第二电离能I2(ZnI2)_____(Cu)填(“大于”或“小于”)。
(3)向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3) 4]2+}。
①H2O分子中心原子的杂化类型为______;分子中的键角:H2O_____NH3填(“大于”或“小于”)。
②通过上述实验现象可知,与Cu2+的配位能力:H2O_____NH3(填“大于”或“小于”)。
③氨硼烷(BH3-NH3)可以作为机动车使用的备选氢来源或氢储存的材料。下列与氨硼烷是等电子体的有______(填编号)
A.乙烷 B.H2O2 C.H3PO4 D. S8
④写出BH3-NH3的结构式(结构中若含配位键用表示)_____。
(4)某磷青铜晶胞结构如图所示。
①其化学式为______。
②若晶体密度为8.82g/cm3,最近的Cu原子核间距为______cm(以NA表示阿伏伽德罗常数,用含NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA、利用反应2MgO+Si![]() 2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
A.消耗的MgO质量为40gB.断裂Si-Si键的数目为NA
C.转移的电子数为2NAD.生成镁蒸气体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法不正确的是
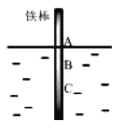
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-=4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌与![]() 的浓硫酸充分反应后,锌完全溶解,同时生成气体
的浓硫酸充分反应后,锌完全溶解,同时生成气体![]() 标准状况下测定
标准状况下测定![]() 。将反应后的溶液稀释至1L,测得溶液中
。将反应后的溶液稀释至1L,测得溶液中![]() ,则下列叙述中错误的是( )
,则下列叙述中错误的是( )
A.反应中消耗的Zn的质量为![]() B.反应中被还原的元素有两种
B.反应中被还原的元素有两种
C.气体A中![]() 和
和![]() 的体积比为3:4D.反应中共转移电子3mol
的体积比为3:4D.反应中共转移电子3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和![]() 的混合物投入足量的
的混合物投入足量的![]() 中,收集到气体
中,收集到气体![]() 标准状况
标准状况![]() ,向反应后的溶液中
,向反应后的溶液中![]() 存在
存在![]() 和
和![]() 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到
加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到![]() ,若上述气体为NO和
,若上述气体为NO和![]() 的混合物,且体积比为
的混合物,且体积比为![]() ,则V可能为
,则V可能为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是___(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g)![]() C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。
①已知下列化学键的键能数据:
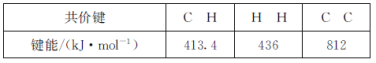
则反应2CH4(g)![]() C2H2(g)+3H2(g)的△H=___kJ·mol-1。
C2H2(g)+3H2(g)的△H=___kJ·mol-1。
②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g)![]() CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨的稳定性较大的是___(填“金刚石”或“石墨”);石墨的燃烧热为___kJ·mol-1。
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为___kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com