
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

(1)碱浸时为提高铝土矿的浸出率可采取的措施是 , 。(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为 。
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替。通入气体时发生反应的离子方程式是 .
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
(5)该生产流程能实现 (填化学式)的循环利用。
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(14分)针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ·mol-1)的实验装置如图所示。
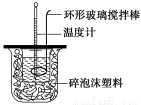
某兴趣小组的实验数值结果小于57.3 kJ·mol-1,原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定
H2SO4溶液的温度
(2)利用氢气可以制取工业原料乙酸。已知:
a.CH3COOH(l)+2O2(g) ==2CO2(g)+2H2O(l) △H = —870.3kJ/mo1
b.C(s)+O2(g) ==CO2(g) △H = —393.5kJ/mo1
c.H2(g) +1/2 O2(g)==H2O(l) △H = —285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是 。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol。
(3)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2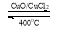 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
①写出此条件下,反应A的热化学方程式__________________ _______。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(12分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
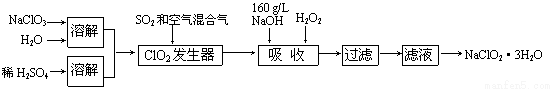
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
请回答下列问题:
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内反应的化学方程式为 。
(3)吸收塔的温度不能超过20℃,原因是 。
(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(5)从滤液中得到NaClO2?3H2O晶体的实验操作依次是 、 、 过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O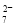 还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(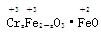 )。处理含1 mol Cr2O
)。处理含1 mol Cr2O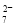 废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
A.x=0.5,a=10 B.x=1,a=5 C.x=2,a=10 D.x=0.5,a=8
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
下列各组离子,在指定的环境中一定能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I-
C.c(S2-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
D.含有大量MnO4-的溶液:H+、Mg2+、SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:填空题
(18分)某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题:

(1)沉淀A的成分是 (填化学式),沉淀B的成分是 (填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为: 、 ;
(3)在操作Ⅰ的名称是 ,其中玻璃棒的作用是 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
0.1 mol NaHCO3中含有 ( )
A.0.2 mol Na+ B.0.05 mol CO C.6.02×1023个 O D.0.1 mol H
C.6.02×1023个 O D.0.1 mol H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com