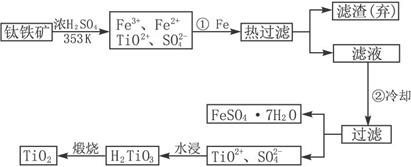
Ⅰ:钛(Ti)被称为继铁、铝之后的第三金属,钝钛和以钛为主的合金是新型的结构材料,主要用于航天工业和航海工业,下列是有关钛的冶炼及应用的问题。
(1)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO
2(金红石)+2C+2Cl
2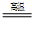
TiCl
4+2CO
已知:C(S)+O
2(g)=CO
2(g) H=-393.5 kJ·mol
-1 2CO(g)+O
2(g)=2CO
2(g) H=-566 kJ·mol
-1
TiO
2(s)+2Cl
2(g)=TiCl
4(s)+O
2(g) H=+141 kJ·mol
-1 则TiO
2(g)+2Cl
2(g)+2C(s)=TiCl
4(s)+2CO(g)的 H=______________。
(2)钠热还原法是冶炼金属钛的方法之一,主要反应原理为:4Na+TiCl
4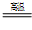
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl
4会强烈水解生成TiO
2,另一原因是____________(用化学方程式说明)。
Ⅱ:高铁酸钠的化学式为Na
2FeO
4,按要求回答下列问题:
(3)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:

。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。
(4)高铁电池是一种新型可充电电池,电解质为碱溶液,其反应式为
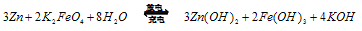
则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。

 TiCl4+2CO
TiCl4+2CO  4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。  。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。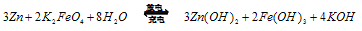 则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。
则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。  天天向上口算本系列答案
天天向上口算本系列答案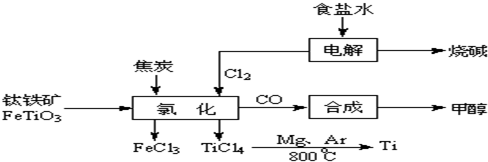
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是: