
| A. | SiCl4、金刚石 | B. | H2S、NF3 | C. | CH2═CHCl、环已烷 | D. | C6H6(苯)、CH3C≡CH |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
A.中心原子都是sp3杂化,其键角相同;
B.中心原子都是sp3杂化,但孤电子对数不同,分子的键角不相同;
C.CH2═CHCl的中心原子是sp2杂化,环己烷中碳原子为sp3杂化,分子的键角不相同;
D.C6H6的中心原子为sp2杂化,而CH3C≡CH中碳原子为sp和sp3杂化,分子的键角不相同.
解答 解:A.SiCl4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,金刚石晶体中的每个碳原子与周围的4个碳原子形成4个σ键,所以金刚石晶体中碳原子是sp3杂化的,中心原子都是sp3杂化,其键角相同,故A错误;
B.H2S中S原子杂化轨道数=σ键数+孤对电子对数=2+$\frac{6-2}{2}$=4,所以采取sp3杂化,分子构型为V型,NF3中氮原子杂化轨道数=σ键数+孤对电子对数=3+$\frac{5-3}{2}$=4,所以采取sp3杂化,分子构型为四面体型,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同,故B正确;
C.氯乙烯分子中每个碳原子杂化轨道数为3,所以采取sp2杂化,环己烷中碳原子杂化轨道数=σ键数+孤对电子对数=4+0=4,为sp3杂化,CH2═CHCl、环已烷中心原子杂化类型不相同,分子或离子的键角不相等,故C错误;
D.苯中碳原子杂化轨道数为3,所以采取sp2杂化,丙炔中含有4个C-H键,两个C-C键,两个π键,即C≡N中含有1个σ键和2个π键,甲基采取sp3杂化,C≡C中的碳为sp杂化,中心原子杂化类型不相同,分子或离子的键角不相等,故D错误;
故选B.
点评 本题主要考查了原子的杂化、分子的空间构型等知识,为高频考点,注意孤电子对的确定以及原子杂化理论的应用为解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 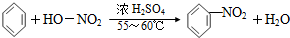 | |
| B. |  | |
| C. | 2 CH3CH2OH+O2 $→_{△}^{催化剂}$ 2 CH3CHO+2 H2O | |
| D. | CH2=CH2+HCl→CH3CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 石墨比金刚石稳定 | |
| C. | 含 1mol 碳原子的石墨比含 1mol 碳原子的金刚石总能量高 | |
| D. | 石墨和金刚石互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
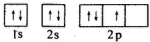
| A. | 洪特规则 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则特例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为 H-F 的键能大于 H-Cl,所以 HF 沸点高于 HCl | |
| B. | SO3是由极性键构成的非极性分子 | |
| C. | 氯化钠和氯化铯晶体中氯离子的配位数相同 | |
| D. | 第一电离能大小比较 Br>Se>As |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl CuCl2 NaNO3 Na2SO4 | |
| B. | BaCl2 Na2CO3 HCl (NH4)2CO3 | |
| C. | FeCl3 HCl NaCl NaOH | |
| D. | Na2CO3 Na2SO4 HCl H2SO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是

(3)据图判断,反应进行至20min时,曲线发生变化的原因 (用文字表达)
(4)10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$ +HCl +HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O | |
| C. | ClCH2CH=CH2+NaOH $→_{△}^{H_{2}O}$ HOCH2CH=CH2+NaCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ +H2O +H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com