
| A. | 5:4 | B. | 4:5 | C. | 5:12 | D. | 12:5 |
分析 混合溶液中只含Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,根据电荷守恒知,Fe2+个数是Cl-、Br-、I-的个数的一半,所以Fe2+、Cl-、Br-、I-的个数之比为4:2:3:3,向溶液中通入氯气,氯气氧化离子先后顺序是I-、Fe2+、Br-,因为碘离子和氯离子所带电荷相等,所以消耗碘离子个数等于生成氯离子个数,如果碘离子完全被氧化生成氯离子,Cl-、Br-的个数之比为5:3<7:3,所以还有部分亚铁离子被氧化,根据2Fe2++Cl2=2Cl-+2Fe3+知,消耗Fe2+与生成Cl-的个数相等,要使Cl-、Br-的个数之比为7:3,则有一半的Fe2+被消耗,据此分析解答,
解答 解:混合溶液中只含Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,根据电荷守恒知,Fe2+个数是Cl-、Br-、I-的个数的一半,所以Fe2+、Cl-、Br-、I-的个数之比为4:2:3:3,向溶液中通入氯气,氯气氧化离子先后顺序是I-、Fe2+、Br-,因为碘离子和氯离子所带电荷相等,所以消耗碘离子个数等于生成氯离子个数,如果碘离子完全被氧化生成氯离子,Cl-、Br-的个数之比为5:3<7:3,所以还有部分亚铁离子被氧化,根据2Fe2++Cl2=2Cl-+2Fe3+知,消耗Fe2+与生成Cl-的个数相等,要使Cl-、Br-的个数之比为7:3,则有一半的Fe2+被消耗,
微粒个数之比等于物质的量之比,所以设Fe2+、Cl-、Br-、I-的物质的量分别是4mol、2mol、3mol、3mol,根据2I-+Cl2=2Cl-+I2知,3mol碘离子完全被氧化消耗1.5mol氯气,2mol Fe2+完全被氧化消耗1mol氯气,所以有2.5mol氯气参加反应;
还有2mol Fe2+未参加反应,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比=2.5mol:2mol=5:4,故选A.
点评 本题考查氧化还原反应有关计算,为高频考点,明确离子反应先后顺序是解本题关键,熟悉离子之间的关系式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径比钙小 | |
| B. | 最高价氧化物为SeO3 | |
| C. | H2Se一定是强酸 | |
| D. | 气态氢化物为H2Se,稳定性比H2S 弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体是分子晶体 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳、乙醇、苯、乙酸 | B. | 苯、甲苯、己烯、己烷 | ||
| C. | 苯、己烯、溴苯、氯化钠溶液 | D. | 乙酸、乙醇、硝基苯、乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:X | D和E 1:3 | B和E 1:4 |
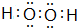 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com