
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对;
C.C6H6分子中含有12个σ键和1个大π键;
D.二氧化碳晶体属于分子晶体,二氧化硅属于原子晶体.
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其价电子排布式;原子轨道处于半满、全满、全空时能量更低稳定;
(3)原子核外没有运动状态相同的电子;
(4)元素周期表根据元素原子的外围电子排布的特征分成五个区域:s区、p区、d区、ds区、f区,s区为第ⅠA、ⅡA族,p区为第ⅢA到零族,d区包括从第ⅢB族~ⅦB族、第Ⅷ八族,ds区为第ⅠB、ⅡB族,f区为镧系和锕系;
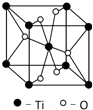
(5)根据均摊法计算晶胞中Ti、O原子数目,进而确定化学式;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大;
②原子数目相等、价电子总数也相等的微粒互为等电子体;
③碳形成4个共价键,氮为三个共价键,氧形成2个共价键,氢形成1个共价键,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H.
解答 解:(1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键,故A正确;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Fe原子核外电子数为26,原子核外没有运动状态相同的电子,即铁原子核外有26种运动状态不同的电子,
故答案为:26;
(4)Ti处于第四周期第ⅣB族,属于d区元素,
故答案为:d;
(5)每个晶胞中含有钛原子数为8×$\frac{1}{8}$+1=2,氧原子数为4×$\frac{1}{2}$+2=4,故化学式为TiO2,
故答案为:TiO2;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为H<C<N<O,
故答案为:H<C<N<O;
②与CNO-互为等电子体微粒含有3个原子、价电子总数为16,故与CNO-互为等电子体微粒的化学式CO2、N2O、SCN-等,
故答案为:CO2或N2O或SCN-;
③碳形成4个共价键,氮为三个共价键,氧形成2个共价键,氢形成1个共价键,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H,
故答案为:N≡C-O-H.
点评 本题是对物质结构与性质的考查,涉及氢键、杂化方式、化学键、电负性、核外电子排布、等电子体、晶胞计算等,是对物质结构主干知识的综合考查,需要学生具备扎实的基础,难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.72 L | B. | 8.98 L | C. | 11.56 L | D. | 13.44 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
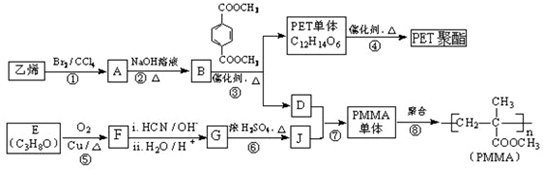
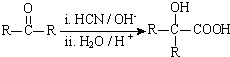 (R、R′代表烃基)
(R、R′代表烃基)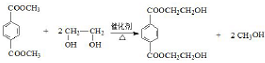 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com