
【题目】亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应:2NOC1+H2O=2HC1+NO↑+NO2↑。某化学兴趣小组设计如图装置用C12和NO制备NOC1。回答下列相关问题:
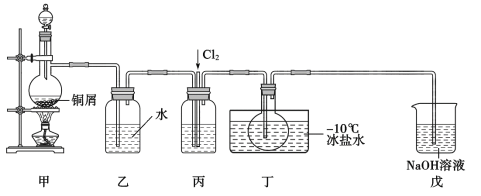
(1)甲装置发生的离子反应方程式为__,装置丙中的液体为__。
(2)实验时,先通入Cl2,待丁中烧瓶内充满黄绿色气体时,再通入NO,这样做的目的是__。
(3)装置丁中冰盐水的作用是__。
(4)经分析该套装置设计上有一处明显缺陷,改进方法是__(用文字描述)。
(5)吸收尾气时,NOCl发生反应的化学方程式为__。
(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)反应完成后,取烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL。则产物中NOCl纯度的计算式为__。
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 浓硫酸 排尽装置中的空气,避免氧化NO 液化亚硝酰氯,便于收集产品 在装置丁和戊之间增加一个气体干燥装置 NOCl+2NaOH=NaCl+NaNO2+H2O ![]() ×100%
×100%
【解析】
由实验装置图可知,装置甲中铜与稀硝酸反应制取一氧化氮,由于一氧化氮易被氧气氧化生成二氧化氮,装置乙中的水用于除去一氧化氮中的二氧化氮,装置丙中盛有浓硫酸,用于干燥和混合一氧化氮和氯气,装置丁用于制备亚硝酰氯,装置戊中的氢氧化钠溶液用于吸收挥发出的硝酰氯,防止污染环境,由于硝酰氯遇水发生反应,所以应在装置丁和戊之间增加一个气体干燥装置,防止水蒸气进入装置丁中硝酰氯与水发生反应。
(1)装置甲中铜与稀硝酸反应生成硝酸铜、一氧化氮和水,的离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;装置丙中盛有浓硫酸,目的是干燥和混合一氧化氮和氯气,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;浓硫酸;
(2)由于一氧化氮易被氧气氧化生成二氧化氮,实验时,先通入Cl2排尽装置中的空气后,再通入NO,防止NO被氧化,故答案为:排尽装置中的空气,避免氧化NO;
(3)由题给信息可知,亚硝酰氯的沸点为-5.5℃,遇冷易转化为液态,则装置丁中冰盐水的作用是液化亚硝酰氯,便于收集产品,故答案为:液化亚硝酰氯,便于收集产品;
(4)由于硝酰氯遇水发生反应,所以应在装置丁和戊之间增加一个气体干燥装置,防止水蒸气进入装置丁中硝酰氯与水发生反应,故答案为:在装置丁和戊之间增加一个气体干燥装置;
(5)由题给化学方程式2NOC1+H2O=2HC1+NO↑+NO2↑和NO+NO2+2NaOH=2NaNO2+H2O可知,NOCl与NaOH溶液反应生成NaCl、NaNO2和H2O,反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O,故答案为:NOCl+2NaOH=NaCl+NaNO2+H2O;
(6)由题给化学方程式2NOC1+H2O=2HC1+NO↑+NO2↑可知,硝酰氯溶于水得到盐酸,由NOC1—HCl—AgNO3可得mg样品中n(NOC1)=n(AgNO3)=cmol/L×V×10—3L×10=0.01cVmol,则则产物中NOCl纯度为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
完成下列填空:
(1)C离子的结构示意图为___,D在周期表中位置是___。
(2)写出E的电子式:__。
(3)A、D两元素形成的化合物属___(填“离子”或“共价”)化合物,1mol该化合物含___mole-。
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式:___。
(5)元素硒(Se)被誉为“生命的奇效元素”,与D元素同主族,则下列关于硒的叙述错误的是___(填序号)。
a.Se元素的最高化合价为+6
b.硒的最高价氧化物对应水化物的化学式H2SeO3
c.硒的非金属性比氧元素弱
d.气态氢化物的热稳定性:H2Se>H2D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含![]() 、
、![]() 元素的物质在生产生活中有重要的用途。回答下列问题:
元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态![]() 核外电子排布式为________。
核外电子排布式为________。
(2)![]() 分子的立体构型为________。
分子的立体构型为________。
(3)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:

①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键______。
的配位键______。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________。
(5)![]() 的酸性强于
的酸性强于![]() 的原因是________,
的原因是________,![]() 的键角小于
的键角小于![]() 的原因是________。
的原因是________。
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________,Ni原子占据的空隙类型为________。已知晶胞参数分别为apm、apm、bpm和![]() ,则该品胞的密度为________
,则该品胞的密度为________![]() (设阿伏加德罗常数的值为NA)
(设阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(![]() )与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )
)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( )

A.图甲中ω1>1
B.图乙中,线A表示正反应的平衡常数
C.在恒容容器中进行,压强不变时反应达到平衡状态
D.当温度为T1、ω=2时,Cl2的转化率约为33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,进行如下反应:C(s)+ H2O(g)CO(g)+ H2(g)
(1)若容器容积为2L,反应10s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为___mol/(L·s)。
(2)若增加碳的量,则正反应速率_____。(选填“增大”、“减小”、“不变”)
(3)该反应达到平衡状态的标志是______。
a.压强不变 b.v正(H2)= v正(H2O) c.c(CO)不变 d.c(H2O)= c(CO)
(4)若升高温度,平衡向右移动,则正反应是___________反应。(选填“吸热”或“放热”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
A. 氢化物的沸点:W<X
B. 简单离子半径:X>Y>Z
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质中重要的组成元素之一。含氮物质的使用既给人类带来福音,又给人们带来一些负面影响。
(1)肥料的三要素,除了氮还有____。
(2)NH3是氮的氢化物,它的空间构型是_____,属于____分子(填写“极性”或“非极性”),N原子的结构示意图是____。
(3)氨的水溶液叫做氨水,它可作为化学肥料。实际使用时,因为有很多不便,所以往往制成铵盐。NH4Cl就是常见的铵盐,NH4Cl属于___晶体,长期使用含NH4Cl的氮肥会使土壤___(填写“酸”或“碱”)化,请结合有关方程式说明原因____。
(4)工业上通常以铁触媒为催化剂,在500℃左右,20~50MPa下合成氨气。采用该压强的原因是____。
(5)含氮废水进入水体会对环境造成污染,某课题小组利用废铝将NO3-还原为N2,从而消除污染。其反应如下:6NO3-+10Al+18H2O→3N2↑+10Al(OH)3+6OH-,该反应中,还原剂是____,被还原的元素是____;每生成2molN2,转移的电子数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为___。(用字母填空,下同);
a.v(NH3)=0.05mol·L-1·min-1
b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.02mol·L-1·min-1
d.v(H2)=0.00lmol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是___。
a.反应速率v(N2)∶v(H2) ∶v(NH3)=1∶3∶2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的应用中,说法正确的是( )
A. 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B. 除去MgCl2中的Fe3+,可以加入NaOH固体
C. 明矾净水的反应:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
D. 加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com