
| A. | Fe3+、K+、S2-、SO42- | B. | Na+、K+、AlO2-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Na+、K+、CO32-、SO42- |
分析 无色溶液中不存在有色离子,酸性溶液中存在大量氢离子,
A.铁离子为有色离子,铁离子能够氧化硫离子,硫离子与氢离子反应;
B.偏铝酸根离子与氢离子反应;
C.四种离子之间不发生反应,都是无色离子,都不与氢离子反应;
D.碳酸根离子与氢离子反应.
解答 解:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.Fe3+为有色离子,Fe3+、S2-之间发生氧化还原反应,S2-与氢离子反应,在溶液中不能大量共存,故A错误;
B.AlO2-与氢离子反应,在溶液中不能大量共存,故B错误;
C.Mg2+、NH4+、Cl-、NO3-之间不反应,都不与氢离子反应,且无色溶液,在溶液中能够大量共存,故C正确;
D.CO32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠着火可用水扑灭 | |
| B. | 将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 | |
| C. | 向含有等量NaI、NaCl的溶液中逐滴加入AgNO3溶液,先产生浅黄色沉淀 | |
| D. | 用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,根据实验现象回答下列问题:
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,根据实验现象回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
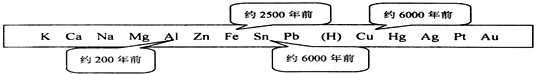
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其分子的空间构型为正四面体.
,其分子的空间构型为正四面体.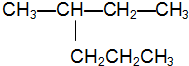
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
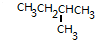 ,则该烃所有可能的结构简式为
,则该烃所有可能的结构简式为 或
或 ;
; .
. 或
或 .
. ,如果要合成
,如果要合成 所用的原始原料可以是AC
所用的原始原料可以是AC查看答案和解析>>
科目:高中化学 来源: 题型:选择题
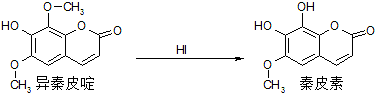 异嗪皮啶具有清热凉血,活血消斑,祛风通络等效,秦皮素具有抗痢疾杆菌功效,用于治疗儿童急性菌痢.它们在一定条件下有如图所示的转化关系.下列有关说法正确的是( )
异嗪皮啶具有清热凉血,活血消斑,祛风通络等效,秦皮素具有抗痢疾杆菌功效,用于治疗儿童急性菌痢.它们在一定条件下有如图所示的转化关系.下列有关说法正确的是( )| A. | 秦皮素的分子式为C10H10O5 | |
| B. | 异嗪皮啶与秦皮素均不能使酸性KMnO4溶液褪色 | |
| C. | 1mol异嗪皮啶最多可与3molNaOH反应 | |
| D. | 异嗪皮啶与秦皮素可用FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com