
 已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )
已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )| A. | ①③⑤ | B. | ①④⑤ | C. | ①④⑥ | D. | ①②⑥ |
分析 ①NaOH溶液与不同量CO2反应可以生成Na2CO3、NaHCO3,二者可以相互转化;
②Ca(HCO3)2溶液与Ca(OH)2溶液反应生成碳酸钙与水,与量无关;
③Na与O2反应产物与温度有关,与反应物的量无关;
④C不足生成二氧化碳,碳过量可以生成CO,CO与二氧化碳可以相互转化;
⑤A1Cl3溶液与NH3•H2O反应生成氢氧化铝沉淀与氯化铵,与量无关;
⑥NaAlO2溶液与盐酸反应,盐酸少量生成氢氧化铝,盐酸过量生成氯化铝,二者可以相互转化.
解答 解:①NaOH溶液与过量CO2反应NaHCO3,与少量CO2反应生成生成Na2CO3,NaHCO3与NaOH反应或加热可以得到Na2CO3,Na2CO3与二氧化碳、水反应可以得到NaHCO3,符合转化关系,故①正确;
②Ca(HCO3)2溶液与Ca(OH)2溶液反应生成碳酸钙与水,与量无关,故②错误;
③钠在常温下与氧气反应生成氧化钠,在加热条件下与氧气反应生成过氧化钠,与反应的量无关,故③错误;
④C不足生成二氧化碳,碳过量可以生成CO,CO与氧气反应可得二氧化碳,二氧化碳越碳反应可得CO,符合转化关系,故④正确;
⑤A1Cl3溶液与NH3•H2O反应生成氢氧化铝沉淀与氯化铵,与量无关,故⑤错误;
⑥NaAlO2溶液与盐酸反应,盐酸少量生成氢氧化铝,盐酸过量生成氯化铝,氢氧化铝与盐酸反应生成氯化铝,氯化铝与氢氧化钠反应生成氢氧化铝,符合转化关系,故⑥正确;
故选:C.
点评 本题以框图形式考查元素化合物性质及转化关系,掌握元素化合物性质是解题关键,注意反应物用量对反应的影响,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:7 | B. | 1:5 | C. | 1:8 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
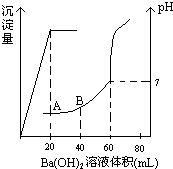 有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | Ca(OH)2和CO2 | C. | NaOH和HCl | D. | Na2CO3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
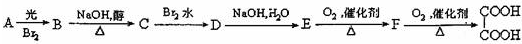
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡有两性 | |
| B. | 两支试管中产生的沉淀都是BaSO4 | |
| C. | 两支试管中的沉淀都是BaSO3 | |
| D. | H2SO3可被H2O2氧化为H2SO4,BaCl2与SO2不反应但能与SO${\;}_{3}^{2-}$反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com