
将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A. 9 B.10 C.11 D.12
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 常温下有下列四种溶液:
常温下有下列四种溶液:| ① | ② | ③ | ④ | |
| 溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1mol?L-1的醋酸 | 0.1mol?L-1的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
(1)环境专家认为可以用铝将水中的NO3- 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平可逆反应:![]()
已知400℃时,1.6 mol NO和NH3混合气体发生以上反应达到平衡后,混合气体的物质的量变为1.7 mol,则被氧化的N的物质的量为 。
(2)已知某温度下0.01 mol/L盐酸溶液中水电离的c(H+)=l x 10-11mol/L,则Kw= ;若在此温度下将pH==a的NaOH溶液与pH=b的盐酸按1:100体积刚好完全反应,a、b应满足关系为 。
(3)有一种白色固体,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一种或几种。①将白色固体用水溶解并过滤,②将滤渣加入足量盐酸中,滤渣全部溶解并放出气体;③向滤液中加入足量浓NaOH溶液,加热,放出能使湿润红色石蕊试纸变蓝的气体,待溶液冷却后,继续滴入适量的稀盐酸,有白色沉淀产生。则该白色固体中一定有 ,可能有 。
查看答案和解析>>
科目:高中化学 来源:2011届河南省焦作市高三上学期期末考试化学试卷 题型:填空题
(12分)(1)环境专家认为可以用铝将水中的NO3-转化为N2 ,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格(不用配平)。
NO3- + + → + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)若4Al(s)+3O2(g) ="2" Al2O3(s) △H=" a" KJ/mol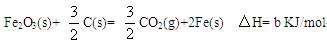
C(s)+O2(g)=CO2(g) △H=" c" KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: 。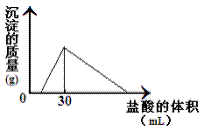
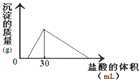
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如上图:则反应过程中产生氢气的总体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2014届福建省、二中高二上学期期末联考化学试卷(解析版) 题型:填空题
目前世界各国获得镁的主要来源从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10-9 |
6.8×10-6 |
5.5×10-6 |
1.8×10-11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成分是CaCO3),你认为 (填“能”或“不能”)通过将贝壳研磨成粉末直接投入海水里制备含镁的沉淀,理由是 。如果不能直接投入,应将贝壳作何处理,试写出化学方程式: 。(若第一个空格填“能”,此空格不填;若填“不能”, 此空格只须第一步处理的化学反应方程式。)
(2)已知某地海水中的镁离子的浓度为1.8×10-3 mol·L-1,则常温下要使镁离子产生沉淀,溶液pH最低应为 。
(3)实验室中常用CaCO3制CO2,其产物之一的氯化钙是应用广泛的化学试剂,可作干燥剂、冷冻剂等。为了测定某氯化钙样品中钙元素的含量,进行如下实验:
(I)准确称取氯化钙样品0.2000g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再加入35mL 0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。
(II)过滤并洗涤(I)所得沉淀。
(III)加入足量的10% H2SO4溶液和适量的蒸馏水,(II)中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热逐滴加入0.05000 mol/L KMnO4溶液16.00mL,恰好完全反应。请回答:
已知滴定过程发生的反应为2MnO4- + 5H2C2O4 + 6H+ ="=2" Mn2+ +10 CO2↑+8 H2O(已配平)
①0.05000 mol/L KMnO4溶液标准溶液应置于 (选填“酸式”或“碱式”)滴定管中。
②滴定终点的现象为 。
③该氯化钙样品中钙元素的质量百分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com