
����Fe��Cu��ɵĺϽ�����Cu��Fe�������ʵ���Ϊa mol��Cu�����ʵ�������Ϊx���гɷ�ĩ��ȫ��Ͷ�뺬b mol HNO ��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺
��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺
��1����ʣ��IJ���ֻ��Cu������Һ�к��еĽ�������Ϊ__________��(д�����п������)
��2������Һ�н�������ֻ��Fe ��Cu
��Cu ʱ����b��ȡֵ��Χ��(��a��x��ʾ)___________��
ʱ����b��ȡֵ��Χ��(��a��x��ʾ)___________��
��3����x��0.5����Һ��Fe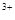 ��Fe
��Fe �����ʵ������ʱ���ڱ�״���¹�����672 mL���塣��a��____________��b��_____________��
�����ʵ������ʱ���ڱ�״���¹�����672 mL���塣��a��____________��b��_____________��
(1) Fe2����Fe2����Cu2�� (2��)
(2) 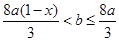 ��2�֣�
��2�֣�
(3) a��0.04mol b��0.12mol ��2�֣�
��������
���������(1) Cu��Fe�Ļ������ϡ���ᷴӦ������������ʣ�࣬����û��ʣ�࣮����������ʣ��ʱ�����ݹ����֪��ʣ����������������
��ʣ��Fe��Cu������Feʣ��ʱ����Һ������Fe��Ӧ��Fe3+��Cu2+�������ڣ�������Һ��ֻ��Fe2+��
��ֻʣ��Cu����Һ��һ����������Cu��Ӧ��Fe3+���������ӹ��棬��Һ����ֻ��Fe2+��
��ͨ����֪����Һ�л����ܴ��ڵ�������Fe2+��Cu2+��
�ܵ�����û��ʣ��ʱ�����ܴ��ڵ�����ǣ���Feǡ�������ᷴӦ����Fe2+��Cuǡ������������Cu2+��������Һ�д��ڵ�������Fe2+��Cu2+��
��ͨ����֪������û��ʣ��ʱ�����ɵ�Fe3+���ַ�Ӧ���������ӹ��棬��Һ�д��ڵ����ӿ��ܵ�Fe2+��Fe3+��Cu2+��
��ͨ���ܡ���֪������û��ʣ��ʱ������ͭȫ�������������ӣ��������ӹ��棬��Һ�д��ڵ����ӿ�����Cu2+��Fe3+��
�����������
|
��������ɷ� |
Fe��Cu |
Cu |
Cu |
-- |
-- |
__ |
|
��Һ�еĽ������� |
Fe2+ |
Fe2+ |
Fe2+��Cu2+ |
Fe2+��Cu2+ |
Fe2+��Fe3+��Cu2+ |
Cu2+��Fe3+ |
��2������Һ��������ֻ��Fe2����Cu2��ʱ��˵��Cuǡ����ȫ��Ӧ������ʣ�࣬��HNO3��Fe����ȫ��Ӧ������Ļ������������ʣ�࣬��Fe2����ᱻ��һ������ΪFe3���������Feʣ�࣬����Cu2��������Ӧ��
3Cu+8HNO3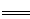 3Cu(NO3)2+2NO��+4H2O
3Cu(NO3)2+2NO��+4H2O
ax 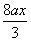
3Fe + 8HNO3 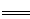 3Fe(NO3)2+2NO��+ 4H2O?
3Fe(NO3)2+2NO��+ 4H2O?
a(1��x) 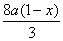
�ܺ�����������n(HNO3)=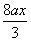 +
+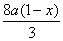 =
=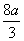
���ԣ�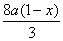 ��b��
��b��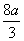
��3������Һ��ΪFe3����Fe2��ʱ��˵��Cu��Fe��ȫ��Ӧ�����δ��ȫ��Ӧ����Cu��Fe���Fe3����Ӧ��������HNO3Ҳ��ȫ��Ӧû��ʣ�ࣨ���������ʣ�࣬��Fe2����ᱻ��һ������ΪFe3������Һ��Fe3����Fe2�������ʵ�����ȣ�˵����һ��Fe��ΪFe3����һ���ΪFe2+
��x=0.5��nFe3��=nFe2�� V(NO)=0.672L
��nFe3��=nFe2��=0.25a mol nCu = 0.5amol
��ʱ3Fe��8HNO3 3Fe(NO3)2��2NO����4H2O
��
3Fe(NO3)2��2NO����4H2O
��
3Cu��8HNO3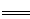 3 Cu (NO3)2��2NO��4H2O
��
3 Cu (NO3)2��2NO��4H2O
��
3Fe(NO3)2��4HNO3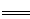 3Fe(NO3)3��NO��2H2O
��
3Fe(NO3)3��NO��2H2O
��
��Ӧ�������ˣ�����Ӧ��ʣ�ࡣ
3Fe ��
8HNO3 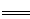 3Fe(NO3)2��2NO����4H2O
��
3Fe(NO3)2��2NO����4H2O
��
0.5a 0.5a��8/3 0.5a 0.5a��2/3
3Cu��8HNO3 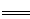 3 Cu (NO3)2��2NO����4H2O
��
3 Cu (NO3)2��2NO����4H2O
��
0.5a 0.5a��8/3 0.5a 0.5a��2/3
3Fe(NO3)2��4HNO3  3Fe(NO3)3��NO��2H2O ��
3Fe(NO3)3��NO��2H2O ��
0.25a 0.25a ��4/3 0.25a
0.5a��2/3 +0.5a��2/3 + 0.25a��1/3 =0.672L/22.4L��mol��1=0.03mol
��ã�a=0.04 mol
b= 0.5a��8/3 + 0.5a��8/3+0.25a ��4/3=3a=3��0.04 mol =0.12 mol



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� | �� | �� | |
| ��������ɷ� | Fe��Cu | Cu | Cu | - | - | - |
| ��Һ�еĽ������� |
| 8 |
| 3 |
| x |
| 3 |
| 8 |
| 3 |
| x |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)�����ӷ�����д���пհ�(�оٳ�ȫ�����ܵ����)
| �� | �� | �� | �� | �� |
��������ɷ� |
|
|
|
|
|
��Һ�еĽ������� |
|
|
|
|
|
(2)����Һ�н�������ֻ��Fe2+��Cu2+ʱ����b��ȡֵ��Χ��__________________(��a��x��ʾ)��
(3)��x=0.5����Һ��Fe3+��Fe2+�����ʵ������ʱ���ڱ�״���¹�����672 mL���塣��a��b��ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)��HNO3���������ӣ���Һ�еĽ������ӺͲ�������ijɷ�����������������������ӷ�����д���пհף�
| �� | �� | �� | �� | �� | �� |
��Һ�еĽ������� |
| Fe2+ |
| Fe2+ Cu2+ |
| Cu2+ Fe3+ |
��������ɷ� | Fe Cu |
| Cu | �� | �� | �� |
(2)����Һ�н�������ֻ��Fe2+��Cu2+ʱ����b��ȡֵ��Χ��?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Fe��Cu��ɵĺϽ�����Cu��Fe�������ʵ���Ϊamol��Cu�����ʵ�������Ϊx���гɷ�ĩ��ȫ��Ͷ�뺬bmol HNO3��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺(��֪��Cu+2Fe3+=2Fe2++Cu2+)
��1����HNO3���������ӣ���Һ�еĽ������ӺͲ�������ijɷ�����������������������ӷ�����д���пհף�
| �� | �� | �� | �� | �� | �� |
��Һ�еĽ������� |
| Fe2+ |
| Fe2+��Cu2+ |
| Cu2+��Fe3+ |
��������ɷ� | Fe��Cu |
| Cu | �D�D | �D�D | �D�D |
��2������Һ�н�������ֻ��Fe2+��Cu2+ʱ����b��ȡֵ��Χ��
��3����x=0.5ʱ����Һ��Fe3+��Fe2+�����ʵ������ʱ���ڱ�״��������672mL���塣��a��b��ֵ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com