
| A、向少许待测液中滴加KSCN溶液无明显变化,再滴入氯水,溶液呈红色,则待测液中含有Fe2+ |
| B、向少许待测液中滴几滴稀硝酸,再滴加少许硝酸银,有白色沉淀生成,则待测液中含有Cl- |
| C、向少许待测液中逐滴加入稀氨水至过量,产生白色胶状沉淀,后又逐渐溶解,则待测液中含有Al3+ |
| D、用洁净的铂丝用盐酸清洗后在酒精灯外焰上灼烧至无色时蘸取待测液在外焰上灼烧,透过蓝色钴玻璃观察火焰为紫色,则待测液中含有K+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,22.4 L H2O中含有的原子总数为3NA |
| B、1molCl2与足量Fe反应,转移的电子数为3NA |
| C、1mol S与足量Cu反应生成Cu2S,转移的电子数为NA |
| D、常温常压下,1mol氦气所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溴乙烷中滴加硝酸银溶液和稀硝酸时,有淡黄色沉淀产生 |
| B、配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 |
C、 制备乙酸乙酯:用如图所示的实验装置 |
| D、鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl的摩尔质量为58.5 |
| B、1.8g 铝在化学反应中失去电子数0.2NA |
| C、28g硅含有6.02×1023个电子 |
| D、1.9g H3O+的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量金属钠保存在煤油里 |
| B、NaOH溶液盛装在带橡皮塞的试剂瓶中 |
| C、HF溶液保存在玻璃试剂瓶中 |
| D、用棕色细口试剂瓶存放氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Na+、OH-、Ba2+ |
| B、Na+、NO3-、SO42-、Mg2+ |
| C、K+、Na+、Cl-、ClO- |
| D、Ca2+、NO3-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c1:c2=2:3 |
| B、X、Y的转化率不相等 |
| C、平衡时,Y和Z的生成速率之比为3:4 |
| D、c1的取值范围为0<c1<0.28 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
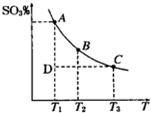
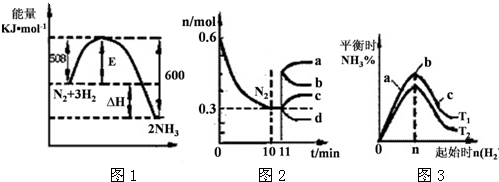
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com