
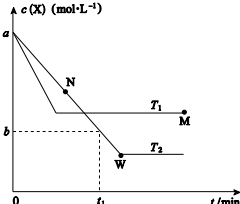
 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )| A. | 该反应进行到M 点放出的热量大于进行到W 点放出的热量 | |
| B. | T2 下,在0~t1 时间内,v(Y)═$\frac{a-b}{{t}_{1}}$mol•L-1•min-1 | |
| C. | M 点的平衡常数小于W 点的平衡常数 | |
| D. | M 点时再加入一定量X,平衡后X 的转化率减小 |
分析 由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
A.根据图象判断参加反应的X的量的多少,反应的X越多,放热越多;
B.根据图中X的浓度变化求出Y的浓度变化,再求反应速率;
C.该反应为放热反应,温度越高,化学平衡常数越小;
D.M点时再加入一定量X,达到的新平衡与原平衡比较,根据压强对平衡的影响分析.
解答 解:由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应;
A.进行到M点X的转化率较低,由于正向是放热反应,所以反应进行到M点放出的热量少,故A错误;
B.T2下,在0~t1时间内,X的浓度变化为:c(X)=(a-b)mol/L,则Y的浓度变化为c(Y)=$\frac{1}{2}$c(X)=$\frac{a-b}{2}$mol/L,所以v(Y)=$\frac{a-b}{2{t}_{1}}$mol•L-1•min-1,故B错误;
C.根据图象可知,温度为T1时反应首先达到平衡状态;温度高反应速率快,到达平衡的时间少,则温度是T1>T2;该反应为放热反应,温度越高,平衡常数越小,则M 点的平衡常数小于W点的平衡常数,故C正确;
D.M点时再加入一定量X,达到的新平衡与原平衡比较,压强增大,增大压强平衡正移,则X的转化率增大,所以M点时再加入一定量X,平衡后X的转化率增大,故D错误;
故选C.
点评 本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等,难度中等,根据图象判断反应为放热反应是解题的关键.注意把握图象中曲线的变化特点,分析外界条件对化学平衡的影响.


科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙 |
| A | 干燥剂 | 浓硫酸、石灰石、无水氯化钙 |
| B | 电解质 | 冰醋酸、铝、水 |
| C | 酸性氧化物 | 二氧化碳、二氧化硫、三氧化硫 |
| D | 碱性氧化物 | 三氧化铁、氧化钠、氧化铝 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制5%的食盐溶液时,将称量的食盐放在烧杯中加适量的蒸馏水搅拌溶解 | |
| B. | 用酸式滴定管准确量取10.00 mL KMnO4溶液 | |
| C. | 用500 mL容量瓶配制1 mol/L的NaOH溶液 | |
| D. | 用pH试纸测得新制氯水的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅单质既不能与酸反应又不能与碱反应 | |
| B. | 晶体硅中每个硅原子与另外四个硅原子形成4个共价键 | |
| C. | 硅与NaOH溶液的反应中NaOH作氧化剂 | |
| D. | 硅元素在地壳中的含量居第一位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu-2e-═Cu2+ | |
| D. | NaHS水解:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
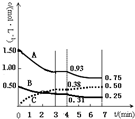 有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3A(g)+B(g)═2C(g) | |
| B. | 若将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 | |
| C. | 若第4 min 时降低温度,到7 min时达到了新的平衡,则此反应的△H<0 | |
| D. | 反应在前3 min的平均反应速率υ(A)=0.31mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
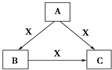 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为O2,则A可为硫化氢 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为Cl2,则C可为FeCl3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Ca2+>Cl->S2- | B. | 第一电离能:Si>C>N | ||
| C. | 电负性:F>S>Mg | D. | 热稳定性:SiH4>H2S>H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com