
| A.CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B.某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥中可以是由KCl饱和溶液制得的琼脂 |
| C.因为铁的活动性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D.理论上说,任何能自发进行的氧化还原反应都可被设计成原电池 |
科目:高中化学 来源:不详 题型:单选题
| A.铁制农具生锈 |
| B.铝导线与铜导线相连接易腐蚀 |
| C.手机锂电池充电 |
| D.纯银饰品在空气中逐渐变暗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu为负极,Zn为正极 |
| B.负极反应为:Zn-2e-=Zn2+ |
| C.正极反应为:Cu2++2e-=Cu |
| D.正极发生氧化反应,负极发生还原反应 |
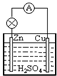
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A为电源正极 |
| B.阳极反应式为:2H2O-4e-═4H++O2↑ |
| C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为10.4克 |
| D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
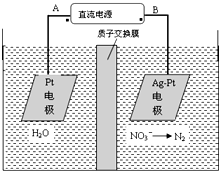
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B.烧杯b中发生反应为2Zn-4e-=2Zn2+ |
| C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A | B | C | D | |
| 两极材料 | Zn片、Cu片 | Cu片、Cu片 | Zn片、Cu片 | Zn片、Cu片 |
| 插入溶液 | 稀H2SO4 | NaCl溶液 | 植物油 | 酒精 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| 放电 |
| 充电 |
| A.充电时每生成1molCH3OH转移6mol电子 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.构成原电池正极和负极的材料必须是两种不同的金属 |
| B.原电池放电时,电流的方向是从负极到正极 |
| C.在原电池中,电子流出的一极是负极,该电极被还原 |
| D.原电池是将化学能转化为电能的装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com