
| A. | 电解质溶液质童增加6.4g | B. | 阴极质量增加6.4g | ||
| C. | 阴极增加的质量小于6.4g | D. | 溶液中Cu2+浓度完全保持不变. |
分析 用含少量银和锌的粗铜做阳极,电极反应为:Cu-2e-=Cu2+,Zn-2e-=Zn2+,纯铜片做阴极,Cu2++2e-=Cu,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了6.4g,依据电子守恒分析,同质量铜和锌相比,锌物质的量小于铜,电子转移减小,阴极增加小于6.4g.
解答 解:电解精炼中,粗铜作阳极,纯铜作阴极,阳极上铜、锌失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,Zn-2e-=Zn2+,纯铜片做阴极,Cu2++2e-=Cu,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了6.4g,依据电子守恒分析,同质量铜和锌相比,锌物质的量小于铜,和铜相比,电子转移减小,阴极增加小于6.4g,阴极质量增加小于6.4g;
故选C.
点评 本题考查了电解原理的分析应用,主要是电解精炼原理的理解,电极反应电子守恒的分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
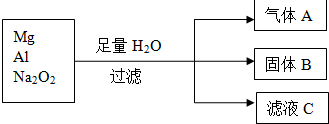
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
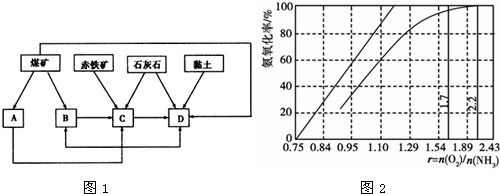
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
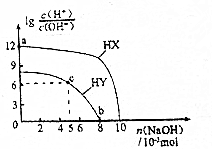
| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n=5 | B. | n<5 | C. | n>5 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.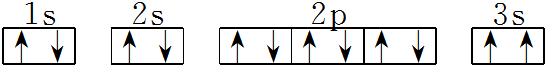 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com