
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
分析 Cu2O和CuO均与氢气发生置换反应生成Cu和水,则反应后固体质量减少6.40g为O元素的质量,含n(O)=$\frac{6.4g}{16g/mol}$=0.4mol,
另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,只有Cu2O与硝酸发生氧化还原反应,n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
设每份中Cu2O和CuO的物质的量分别为x、y,由电子守恒及原子守恒可知,
$\left\{\begin{array}{l}{x+y=0.4}\\{x×2×(2-1)=0.2×(5-2)}\end{array}\right.$
解得x=0.3mol、y=0.1mol,
由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+2n(Cu2O),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],再根据c=$\frac{n}{V}$计算硝酸的浓度.
解答 解:Cu2O和CuO均与氢气发生置换反应生成Cu和水,则反应后固体质量减少6.40g为O元素的质量,含n(O)=$\frac{6.4g}{16g/mol}$=0.4mol,
另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,只有Cu2O与硝酸发生氧化还原反应,n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
设每份中Cu2O和CuO的物质的量分别为x、y,由电子守恒及原子守恒可知,
$\left\{\begin{array}{l}{x+y=0.4}\\{x×2×(2-1)=0.2×(5-2)}\end{array}\right.$
解得x=0.3mol、y=0.1mol,
由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+2n(Cu2O)=0.1mol+0.3mol×2=0.7mol,
由氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,
可知c(HNO3)=$\frac{1.6mol}{0.5L}$=3.2mol/L,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握原子守恒及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.| A. | 丙也可由W、Y组成的某种化合物与K直接反应制得 | |
| B. | K、L、M 中沸点最高的是M | |
| C. | 原子半径:W<X<Y | |
| D. | 元素的非金属性:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
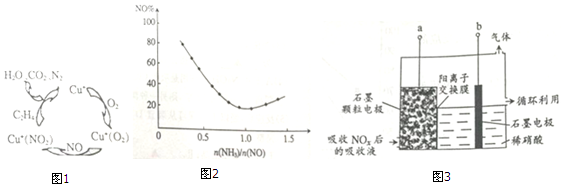
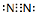 .下列能实现人工固氮的是D.
.下列能实现人工固氮的是D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t(min) | 2 | 4.5 | 5 | 6 |
| X转化率 | 30% | 40% | 70% | 70% |
| A. | 随着反应的进行,混合气体的密度不断增大 | |
| B. | 反应在5.5min时,v正(X)=v逆(Z) | |
| C. | 6min时,容器中剩余1.4mol Y | |
| D. | 其他条件不变,将X的物质的量改为10mol,则可得4mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 结论或推测 | |
| A | Na与冷水激烈反应,生成H2 | Mg与沸水迅速反应,生成H2 |
| B | F2与H2暗处剧烈化合,生成的HF很稳定 | I2与H2加热也能化合,生成的HI也很稳定 |
| C | Na与O2加热反应生成Na2O2 | IA元素单质与O2加热反应均生成过氧化物 |
| D | H3PO4是中强酸,As是P的同主族非金属元素 | H3AsO4是强酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com