
 CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
 CH3OH(g)����H<0 ������
CH3OH(g)����H<0 ������ ��
�� | ʵ���� | T/�� | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
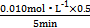 ��3="0.003" 0 mol��L-1��min-1;�����ݷ�Ӧʽ��֪����ѹǿƽ������,ת���ʼ�С,����p1<p2;�á����������������100 ��ѹǿΪp1ʱƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CH4)="0.005" mol��L-1��c(H2O)="0.015" mol��L-1��c(CO)="0.005" mol��L-1��c(H2)="0.015" mol��L-1,K=
��3="0.003" 0 mol��L-1��min-1;�����ݷ�Ӧʽ��֪����ѹǿƽ������,ת���ʼ�С,����p1<p2;�á����������������100 ��ѹǿΪp1ʱƽ��ʱ�����ʵ�Ũ�ȷֱ�Ϊc(CH4)="0.005" mol��L-1��c(H2O)="0.015" mol��L-1��c(CO)="0.005" mol��L-1��c(H2)="0.015" mol��L-1,K=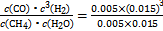 =2.25��10-4;(2)��Cѡ���൱�ڼ�ѹ��Dѡ���൱�ڼ�ѹ;�����ʵ��Ӧ��ֻ��һ������,ʵ��1��2ѹǿ��ͬ,�¶���ͬ;ʵ��2��3�¶Ȳ�ͬ,������ͬ;ѹǿԽ��ת����Խ��,px��ѹǿС��
=2.25��10-4;(2)��Cѡ���൱�ڼ�ѹ��Dѡ���൱�ڼ�ѹ;�����ʵ��Ӧ��ֻ��һ������,ʵ��1��2ѹǿ��ͬ,�¶���ͬ;ʵ��2��3�¶Ȳ�ͬ,������ͬ;ѹǿԽ��ת����Խ��,px��ѹǿС��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����������ܺ� | B��ʹ��Ӧ��Ļ�ѧ�������ƻ� |
| C��ʹ��Ӧ����ȫ | D��ʹ��Ӧ�ų���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�| �¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ0.4
A(g)+B(g)��ƽ�ⳣ����ֵΪ0.4�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
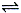 B(g) +C(g)���ݻ�Ϊ1.0L���ܱ������н��У�A�ij�ʼŨ��Ϊ0.050mol/L���¶�T1��T2��A��Ũ����ʱ���ϵ��ͼ��ʾ���ش��������⣺
B(g) +C(g)���ݻ�Ϊ1.0L���ܱ������н��У�A�ij�ʼŨ��Ϊ0.050mol/L���¶�T1��T2��A��Ũ����ʱ���ϵ��ͼ��ʾ���ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��v��>v��>v�������������� | B��v��>v��>v�� |
| C��v��>v��>v�� | D��v����v����v�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g)��6H2O(g)������ѧ��Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)[��λ��mol/(L��s)]��ʾ������ȷ��ϵ��( )
4NO(g)��6H2O(g)������ѧ��Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)[��λ��mol/(L��s)]��ʾ������ȷ��ϵ��( )A�� v(NH3)��v(O2�� v(NH3)��v(O2�� | B�� v(O2)��v(H2O�� v(O2)��v(H2O�� |
C��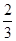 v(NH3)��v(H2O�� v(NH3)��v(H2O�� | D�� v(O2)��v(NO) v(O2)��v(NO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 pZ(g)+qQ(g),ʽ��m��n��p��qΪ��ѧ����������0~3 min��,���������ʵ����ı仯���±���ʾ:
pZ(g)+qQ(g),ʽ��m��n��p��qΪ��ѧ����������0~3 min��,���������ʵ����ı仯���±���ʾ:| �� ���� ʱ�䡡 | X | Y | Z | Q |
| ��ʼ/mol | 0.7 | | 1 | |
| 2 minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 minĩ/mol | | | 0.8 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com