
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
【答案】C
【解析】根据化学平衡三段式列式计算,平衡时C的浓度为0.8 mol·L-1,物质的量为1.6mol
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 1.6 0.8
平衡量(mol) 1.8 0.6 1.6 0.8
依据上式分析计算:
A、根据浓度变化量之比等于化学计量数之比可知x=4,故A正确;B、2min内B的反应速率=0.4mol/(2L·2min)=0.1 mol·(L·min)-1,故B正确;
C、反应前后气体总质量不变,混合气体密度不变,不能表明该反应已达到平衡状态,故C错误;D、 B的转化率=0.4mol/1mol=0.4,即 B的转化率为40%,故D正确;故选C.


科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为________,其离子结构示意图为:_______。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为___。
(3)关于C、D 两种元素说法正确的是__________(填序号)。
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为______。
(5)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(6)比较Y元素与其同族短周期元素的氢化物的熔沸点高低__ >___ (填氢化物化学式),理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A. CuS的溶解度大于PbS的溶解度
B. 原生铜的硫化物具有还原性,而铜蓝没有还原性
C. CuSO4与ZnS反应的离子方程式是![]()
![]() CuS↓
CuS↓
D. 整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是

A. 分子中所有碳原子一定处于同一平面
B. 不能与饱和Na2CO3溶液反应
C. 该物质能使溴的四氯化碳溶液褪色
D. 1mol化合物X最多能与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
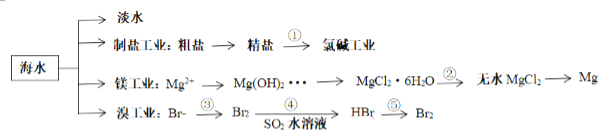
A. 海水制盐后可以利用氯碱工业,电解饱和食盐水制备金属钠
B. 在整个工艺制备过程中,未发生置换反应操作
C. 由 MgCl2·6H2O得到无水 MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块钠放在坩埚里加热,下列实验现象正确的是( )
①金属先熔化 ②在空气中燃烧,火焰呈黄色 ③燃烧时火星四射
④燃烧后生成淡黄色固体 ⑤燃烧后生成白色固体
A. ①②③ B. ①②④ C. ①②⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题:
(1)写出基态Cu2+的外围电子排布式:__________.C、N、O三种元素的第一电离能由小到大的顺序为__________(用元素符号表示).
(2)PO43-的空间构型是____________________________________________.
(3)氨基乙酸铜的分子结构如图,其中碳原子的杂化方式为______________.

(4)铁和铜是重要的金属,Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.六氰合亚铁离子[Fe(CN)6]4-中不存在___________________.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(5)在硫酸铜溶液中加入过量氨水,生成配合物离子四氨合铜离子,请写出四氨合铜离子的结构式_________.
(6)NaCl晶胞中若r(Na+)=a pm,r(Cl-)=b pm,则NaCl晶胞的空间利用率为________.(晶胞中离子以密堆积方式存在,用含有a,b的列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液显中性,金属离子已完全沉淀,沉淀质量为39.2g,求(写出计算过程):
(1)原固体混合物中Cu和Cu2O的物质的量之比为_____________;
(2)产生的NO在标准状况下的体积是________毫升?
(3)硝酸的物质的量浓度是________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是:
A. 铅蓄电池放电时,负极反应式为PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
B. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=== Cu
C. 生铁中含碳,抗腐蚀能力比纯铁强
D. 铁制品上镀锌,锌做阴极,铁制品做阳极,电解质溶液中含Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com