
| A. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | B. | 2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ | ||
| C. | 2CO+O2═2CO2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
科目:高中化学 来源: 题型:选择题
| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g 18O2中含有的氧原子数是2×6.02×1023 | |
| B. | 1 mol N2和CO的混合气体中含有的分子总数是2×6.02×1023 | |
| C. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023 | |
| D. | 1.0 L 0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2n+3-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
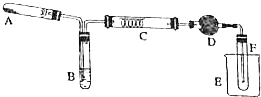 某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)
某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
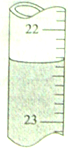 准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:| HCl溶液起始读数 | HCl溶液终点读数 | |
| 第一次 | 2.15mL | |
| 第二次 | 3.10mL | 21.85mL |
| 第三次 | 4.20mL | 22.95mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
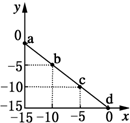 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )| A. | 该温度高于25℃ | |
| B. | 图中a点溶液呈碱性 | |
| C. | 该温度下,0.01 mol•L-1的HCl溶液中,由水电离出的H+浓度为10-12 mol•L-1 | |
| D. | 该温度下,等体积浓度均为0.01 mol•L-1的HCl溶液与NaOH溶液恰好完全反应的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2n NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com