
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如下图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是( )

A. 一定含有MgCl2和FeCl2
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有Al,其质量为4.5 g
D. 一定含有(NH4)2SO4和MgCl2,且物质的量相等
【答案】D
【解析】14.05g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可以知道,一定含有硫酸铵与氢氧化钠反应生成氨气为2.24L,剩余的气体只能是氢气,体积为3.36L,说明原混合物中一定含有铝;
14.05g固体加入过量的氢氧化钠溶液中产生白色沉淀2.9g,久置无变化,因为氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为2.90g,一定不存在FeCl2;
14.05g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,以此解答该题。
结合以上分析,
A. 根据加入氢氧化钠溶液后生成白色沉淀,且白色沉淀没有变化,则固体混合物中一定含有MgCl2,一定不含FeCl2,故A错误;
B.根据以上分析可以知道,固体混合物中一定含有MgCl2和AlCl3,故B错误;
C. 固体混合物中一定含有Al,可以根据标况下3.36L氢气可以计算出铝的物质的量为0.1mol,质量为2.7g,故C错误;
D.根据以上分析可以知道,原固体混合物中一定含有(NH4)2SO4和MgCl2,所以D选项是正确的;
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃X(相对分子貭量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种高分子。

回答下列问题:
(1)B的名称是________,物质Y是乙酸吗_____(填“是”或 “不是”)?反应⑧属于____反应。H的含N官能团的名称是______。
(2)反应⑥、⑦两步能否互换____(填“能”或“不能”),理由是__________。
(3)上图中反应②的化学方程式是__________。
(4)比 相对分子质量大14的同系物M的同分异构体中,写出能同时满足以下条件的M(不考虑立体异构):_____________。
相对分子质量大14的同系物M的同分异构体中,写出能同时满足以下条件的M(不考虑立体异构):_____________。
①苯环上的一氯代物有2种,②能发生水解反应,③与FeCl3溶液能够发生显色反应。
(5)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 最合理的方案(不用写条件)__________。
最合理的方案(不用写条件)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于某些离子的检验及结论中一定正确的
A. 加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCO3﹣+AlO2﹣+H2O═CO32﹣+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
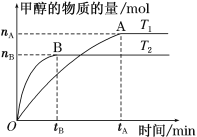
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图错误的是( )
A | B | C | D |
将二氧化硫通入到一定量氯水中 | 将NaHCO3溶液滴入到一定量Ba(OH)2溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大强调树立“社会主义生态文明观”。下列做法不应该提倡的是( )
A.研发可降解高分子材料,缓解白色污染问题
B.扩大铅蓄电池、含汞干电池的生产,满足消费需求
C.采用碳捕集和封存技术,逐步实现二氧化碳零排放
D.大力发展太阳能、风能等清洁能源,减少对化石燃料的依赖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
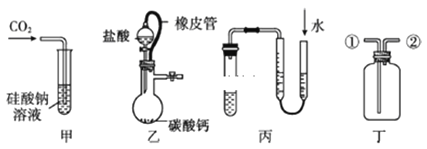
A. 甲装置:可用来证明碳酸的酸性比硅酸强
B. 乙装置:橡皮管的作用是平衡气压,使液体顺利流下
C. 丙装置:用图示的方法不能检查此装置的气密性
D. 丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com